Braquiterapia intersticial de alta dosis:
Una mirada hacia atrás a un arte olvidado

Jonathan Huang, PhD
Unidad de Radiooncología
Centro Comprensivo de Cáncer UPR
Tel: (787) 200-3220 Ext.8340/8306

Julio Díaz, MD
Radiooncólogo
Centro Comprensivo de Cáncer UPR
Introducción
Una de las modalidades disponibles en el campo de la radioterapia terapéutica oncológica es la braquiterapia intersticial, cuyo origen se remonta a 1896 con el descubrimiento de la radioactividad por el físico francés Henri Becquerel. Posteriormente, los esposos Curie descubrieron el radio y, en 1903, el Dr. Pierre Curie sugirió la inserción directa a un tumor óseo de esta fuente de radioactividad, determinándose después que la masa tumoral disminuyó de tamaño. Así nació la braquiterapia terapéutica.
Braquiterapia de dosis alta y baja
Como se ha mencionado, en la braquiterapia se coloca una fuente de radiación –aislada y protegida– directamente dentro o cerca de una masa tumoral. En comparación con la braquiterapia de baja dosis (LDR), la braquiterapia de dosis alta (HDR) suele ser más conveniente porque requiere un tiempo de tratamiento más corto con menos sesiones y usando aplicadores más pequeños. En la mayoría de los pacientes estas intervenciones suelen ser ambulatorias.
Tumores a tratar con braquiterapia HDR
La braquiterapia HDR se puede usar para el cáncer ginecológico y en algunos casos de cáncer de mama y ciertos sarcomas. La braquiterapia HDR también se puede utilizar en pacientes con cáncer de próstata localizado, con la ventaja de mayor preservación de la vejiga y el recto.
Beneficios de la braquiterapia HDR
La braquiterapia HDR permite administrar altas dosis de radiación directamente al tumor y de forma inmediata. Debido a su corta penetración de tejidos no expone a radiación a familiares ni al personal médico.
La braquiterapia HDR suele ser más práctica y eficiente que la braquiterapia LDR, pudiéndose dar de forma ambulatoria y sin hospitalizaciones. El paciente puede caminar con mayor prontitud evitándose las complicaciones de la inmovilidad. Además, con el sistema de planificación de la braquiterapia HDR podemos controlar con precisión la cantidad de radiación suministrada a la región, limitando la radiación que llega al tejido sano cercano.
Condiciones tratadas con braquiterapia
La braquiterapia HDR se utiliza para tratar a pacientes con cáncer ginecológico, en específico cáncer cervical, cáncer de endometrio y cáncer vaginal.
Los dispositivos de tratamiento utilizados incluyen:
- Cilindro vaginal;
- Tándem y ovoides;
- Intersticial; y
- Aplicador de superficie.
Además de los diagnósticos mencionados, otros tipos de tumores pueden considerarse para la braquiterapia HDR de forma individualizada:
- Cáncer de esófago;
- Cáncer de cabeza y cuello;
- Cáncer pulmonar;
- Otros tumores regionales locales; y
- Tumores de tejido blando.
Procedimiento de braquiterapia HDR
En la braquiterapia HDR se coloca una fuente protegida de radiación de alta energía en forma directa dentro del tumor con aplicadores especialmente diseñados, como placas radiactivas, agujas, tubos, cables o pequeñas «semillas» de diferentes isótopos. Estos materiales radiactivos se colocan sobre el tumor o se implantan dentro del tumor o se colocan dentro de una cavidad corporal rodeada por el tumor. Para que el paciente se sienta más cómodo, a menudo se administran analgésicos o medicamentos relajantes antes del procedimiento. Una vez colocado el aplicador, se realizan imágenes para verificar la colocación y para planificar el tratamiento. Es importante crear un plan de tratamiento individualizado para asegurar que todo el volumen tumoral sea debidamente expuesto a una dosis de radiación óptima. El uso de los tratamientos de alta energía utilizados en braquiterapia HDR (generalmente Iridio-192) implica que los médicos puedan administrar dosis adecuadas de radiación en pocos minutos insertando y luego retirando las fuentes radiactivas sin mayor peligro de contaminación externa.
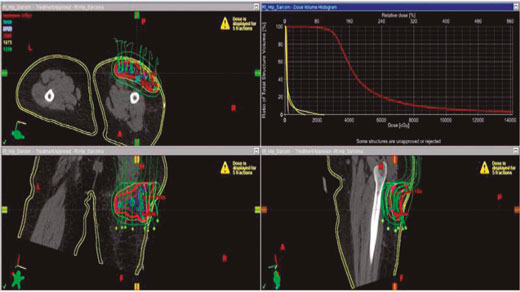
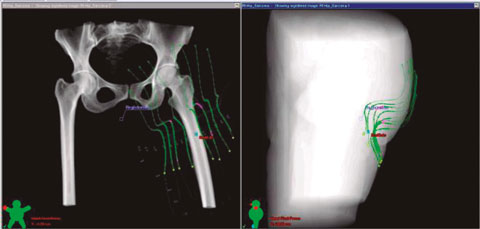
Ejemplo de uso de braquiterapia intersticial en sarcoma de tejido blando
En este ejemplo, una vez que se extirpó el tumor y que se expuso el lecho tumoral, se comprobó que las estructuras vasculares y neurales estén a 1 cm del volumen objetivo de planificación proyectada (PTV).
Luego de marcarse los márgenes con los puntos de referencia adecuados, se insertaron catéteres con agujas de braquiterapia, en dirección medial a lateral y proximal a distal del lecho tumoral, para administrar la radiación prescrita.
En la cicatriz se ubicaron los catéteres a 1 cm de distancia entre sí, asegurándose al lecho tumoral con sutura quirúrgica absorbible. Después de haber asegurado que hay una buena hemostasis y que todos los catéteres se colocaron en las posiciones correctas, se fijaron todos con sutura, cerrándose la incisión y el drenaje. Luego de unos 3 días de hospitalización para observar síntomas de sangrado o infección y de 5 días con antibiótico de amplio espectro, se hizo una simulación con tomografía computarizada 3D con fuentes radioactivas ficticias para calcular el largo activo (active length) del tratamiento y desarrollar el plan terapéutico. Con el debido consentimiento informado y la aprobación de un plan formal de tratamiento se pudo iniciar la braquiterapia.
Conclusión
La braquiterapia intersticial es una buena opción para un grupo seleccionado de pacientes. Permite disminuir la dosis de radiación externa a los tejidos sanos vecinos, proveyéndose la dosis precisa al lecho tumoral. Así se puede lograr un control local excelente en tumores localmente agresivos, disminuyéndose los efectos secundarios tardíos en tejidos adyacentes. El éxito se logra con una buena selección de los pacientes y el trabajo combinado del cirujano y del radiooncólogo.
Referencias
- NSABP PROTOCOL B-39 RTOG PROTOCOL 0413.
- The American Brachytherapy Society consensus statement for accelerated partial-breast irradiation (2017).








