Mieloma múltiple: Avances y controversias en su tratamiento
El mieloma múltiple es una malignidad hematológica cuyo tratamiento representa un gran reto, ya que ninguna de las terapias estándares disponibles en la actualidad se considera curativa. El mayor conocimiento de esta enfermedad en la última década ha dado paso a la creación de nuevos medicamentos que son tanto o más efectivos que los tratamientos tradicionales. Estos representan la promesa de mejores resultados en el futuro.

Alexis M. Cruz Chacón MD
Hematólogo-Oncólogo
Especialista en Trasplante de Médula Ósea en Adultos
Director Médico, Programa de Trasplante
de Médula Ósea del Hospital Auxilio Mutuo
Conceptos básicos sobre mieloma múltiple
La condición conocida como mieloma múltiple (MM) es la gammapatía monoclonal maligna más común. Representa el 10% de las malignidades hematológicas y predomina en la población de adultos mayores (edad promedio: 65 años).
El MM se caracteriza por la infiltración de células plasmáticas en la médula ósea. Estas producen un componente monoclonal (CM) en suero y/u orina, conocido como “pico monoclonal” o M-spike. El CM está compuesto por cadenas pesadas de inmunoglobulina (IgG, IgA, IgM). Las células plasmáticas también pueden producir cadenas ligeras de inmunoglobulina (kappa, lambda), que no son detectadas como un CM.

Las manifestaciones clínicas más comunes de los pacientes con MM son: hipercalcemia (15-20%), insuficiencia renal (20-25%), anemia (30%) y lesiones osteolíticas sintomáticas (70%). Para estos síntomas se utiliza el acrónimo del inglés “CRAB” (calcio; riñón; anemia; bone –o hueso–). En presencia de cualquiera de estos hallazgos clínicos, el MM se considera sintomático.
Algunos pacientes con MM se mantienen sin ningún síntoma (MM asintomático o quiescente). Hay varios factores pronósticos importantes que hay que considerar en todo paciente de MM: edad, estado general (condición física y funcional, y comorbilidades), citogenética y respuesta al tratamiento inicial.
Tratamiento inicial
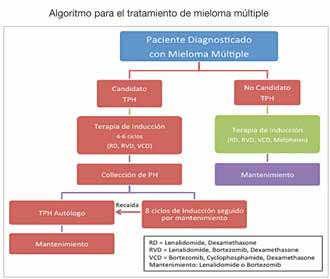
Actualmente el consenso es que un paciente con MM solo debe tratarse si tiene signos o síntomas (CRAB). Sin embargo, hay un grupo de pacientes con MM quiescente de alto riesgo (infiltración de células plasmáticas en médula ósea ≥60%, proporción de cadenas ligeras ≥100, o más de una lesión focal ósea demostrada por MRI) que se benefician de tratamiento.
Por muchos años el tratamiento estándar de primera línea para MM ha sido terapia de inducción seguida por trasplante de progenitores hematopoyéticos (TPH) autólogo. Por lo tanto, el plan de tratamiento inicial depende de si se considera al paciente como candidato a trasplante. Para determinar esto, deben tomarse en cuenta no solo la edad del paciente sino factores importantes como su condición física, su estado funcional y las comorbilidades.
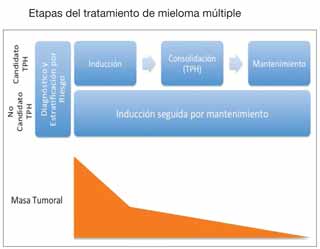
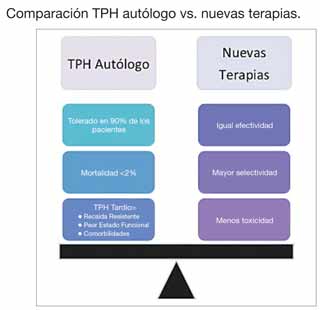
En el pasado, la terapia de inducción consistía en una combinación de quimioterapia y/o esteroides en dosis elevadas. En la actualidad, gracias al mejor entendimiento de la biología y de los distintos procesos que llevan al desarrollo del MM, han surgido nuevas terapias biológicas y moleculares que son tan efectivas como la quimioterapia tradicional pero mucho menos tóxicas (bortezomib, lenalidomide, carfilzomib, pomalidomide). Gracias a la incorporación de estas terapias en los protocolos de inducción se han logrado mejores tasas de remisión completa (RC) pre y postrasplante. Esto, en conjunto con el potencial de utilización de los nuevos fármacos como terapias de mantenimiento, ha creado la controversia de si aún es necesario realizar un TPH autólogo como parte del tratamiento inicial de MM. Actualmente se realizan estudios clínicos con el fin de contestar esta pregunta. Mientras tanto, se recomienda continuar utilizando el tratamiento estándar.
Trasplante de médula ósea
El TPH autólogo se considera parte del tratamiento estándar para pacientes de MM que han respondido adecuadamente a la terapia de inducción inicial o de rescate luego de una recaída. Es importante mencionar que el TPH autólogo no se considera un tratamiento curativo para MM. El beneficio de un TPH autólogo consiste en prolongar la sobrevida libre de enfermedad (SLE). Una estrategia implementada actualmente para prolongar este periodo es la utilización de las nuevas drogas como terapias de mantenimiento postrasplante. Aquellos pacientes que sufran una recaída a un año o más luego de un TPH autólogo y respondan a tratamiento pueden ser considerados para un segundo TPH autólogo. También se benefician de un segundo trasplante pacientes que no alcancen al menos una muy buena respuesta parcial tras el primer TPH autólogo.
Se ha estudiado el uso de TPH alogénico en MM. La mayoría de los estudios, realizados con terapias de condicionamiento mieloablativas, han demostrado una tasa de recaída similar a la obtenida con TPH autólogo con una mortalidad mucho más alta. Los mejores resultados con TPH alogénico se han obtenido en pacientes jóvenes cuando se utilizan regímenes de intensidad reducida y cuando se realiza previamente un TPH autólogo para conseguir una mejor disminución de la carga tumoral. Actualmente la utilización de TPH alogénico en MM se considera experimental y no debe ofrecerse fuera de un estudio clínico.
Conclusión
No hay duda de que los descubrimientos y avances en el entendimiento de la biología del MM siguen dando lugar a nuevas terapias que son igual de efectivas y menos tóxicas que los tratamientos tradicionales. Sin embargo, la realidad es que MM aún se considera una condición incurable. Deben esperarse los resultados y el seguimiento a largo plazo de estudios en los que se comparan los tratamientos clásicos frente a las nuevas terapias para poder comparar su efectividad. La integración de las nuevas terapias con los tratamientos tradicionales, incluyendo el TPH, podría también representar la esperanza de mejores resultados en el futuro y una posible cura del MM.