ONCOLOGÍA
Terapia con células propias con receptor antígeno quimérico (CAR-T):
El ejemplo de Emily y cómo salvó su vida

Luis A. Clavell, MD
Profesor Pediatría, RCM-UPR
Medicina del Cáncer, CCCUPR
Director Ejecutivo Centro Comprensivo de Cáncer UPR
La historia de Emily y su impacto
En 2011, la niña Emily de 9 años fue diagnosticada de leucemia linfocítica aguda de células B y recibió el tratamiento recomendado que beneficia al 85% de los niños afectados por esta condición. Lamentablemente, luego de una respuesta inicial favorable, tuvo una recurrencia de su enfermedad. Se intentó un segundo curso de tratamiento, pero varios meses después tuvo otra recurrencia. Esto demostró la agresividad de su enfermedad. Se recomendó considerar otras opciones, ya que las alternativas conocidas hasta el momento no ofrecían mucha esperanza.
Así, en el Hospital de Niños de Filadelfia evaluaron la posibilidad de una terapia experimental con células propias del paciente modificadas para controlar selectivamente las células leucémicas. Esta terapia celular inmunológica era un desarrollo reciente de científicos de la Universidad de Pensilvania. El tratamiento con células antólogas modificadas genéticamente –específicamente las células T con receptores antigénicos quiméricos que reconocen la proteína CD-19– se había utilizado ya con resultados impresionantes en pacientes adultos con linfomas de células B que expresaban esta proteína.
La mayoría de los linfomas y leucemias linfocíticas de células B expresan esta proteína en su superficie; la leucemia (resistente) en Emily también expresaba CD-19.
Luego de las evaluaciones, se determinó que Emily era elegible para dicho tratamiento experimental y así se procedió luego de obtener las autorizaciones necesarias. Ocho años más tarde Emily se encuentra en buen estado de salud y sin evidencia de leucemia. Este fue el primer caso pediátrico, incurable y refractario a los tratamientos existentes, en que se utilizó esta nueva opción con un éxito e impacto dramáticos.
La evolución en inmunoterapias y CAR-T
Luego de más de 100 años buscando cómo utilizar el sistema inmunológico, se han logrado intervenciones de inmunoterapia con impresionantes efectos terapéuticos. En un corto tiempo, la inmunoterapia se ha convertido en el tratamiento recomendado para un grupo creciente de malignidades. Las células T con receptores antigénicos quiméricos (CAR-T, Chimeric Antigen Receptor T-cell) son un ejemplo del poder del sistema inmunológico para tratar el cáncer; en este caso, para eliminar las células leucémicas.
Las CAR-T son el resultado de ingeniería celular sofisticada, que ha pasado por varias “generaciones” de desarrollo. Las últimas, la 3ª y 4ª generación de CAR-T, tienen las siguientes características:
- Anticuerpo extracelular con una sola cadena con fragmento variable similar al receptor de células B que reconoce el antígeno de interés (CD-19 en este caso), sin requerir presentación por molécula del complejo mayor de histocompatibilidad (MHC);
- Incluye dominio del receptor de células T para generar mensaje intracelular simulando la señal del receptor de células T (TCR) al encuentro con antígeno; y
- Dos o tres dominios coestimuladores del mensaje intracelular (CD28, 4-1BB y/o CD27 o CD134; Figura 1).1 El resultado es que, al encontrarse con el antígeno de interés, CD-19, se activan la coestimulación y la célula T (CAR-T) y se elimina la célula de interés.
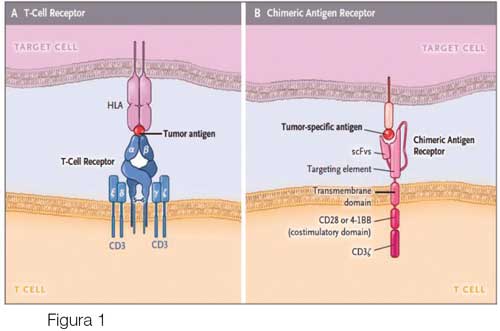
Es crítico seleccionar el antígeno apropiado, ya que las células CAR-T matan a cualquier célula que exprese el antígeno reconocido. El antígeno CD-19 (cluster determinant 19) es un marcador de células-B altamente expresado en leucemia linfocítica aguda de células-B y en otras malignidades de células-B. Las CAR-T contra CD-19 no discriminan entre las células leucémicas y las células-B normales. Por eso, el tratamiento con ellas causa deficiencia en la producción de inmunoglobulinas, requiriendo su reemplazo por vía intravenosa.
Los resultados al usar CAR-T dirigidos al antígeno CD-19 son impresionantes, como refleja el caso de Emily, con respuestas en más del 80% de los pacientes afectados con leucemia linfocítica aguda. Estas células persisten en el paciente por más de un año, con un efecto prolongado.
Efectos adversos y toxicidad
Las CAR-T penetran al sistema nervioso central, rompiendo la barrera de este santuario farmacológico de las células leucémicas. Esto podría relacionarse con la toxicidad neurológica que se puede observar en un número significativo de pacientes.
La toxicidad más común y seria del tratamiento con CAR-T es el síndrome de liberación de citoquinas (cytokine release syndrome, CRS) que se caracteriza por fiebre, síntomas parecidos a la influenza, hipotensión, hipoxemia y posible toxicidad en múltiples órganos. Está mediado por la activación de las células T al enfrentar a su antígeno, liberando las citoquinas IL-2, IFN-γ, GM-CSF y (más crítico) IL-6. Estos síntomas tienden a ocurrir en los primeros 7 días luego de la infusión.2
Los esteroides pueden ser efectivos para controlar estos efectos secundarios, pero podrían, a su vez, reducir el efecto antileucémico. Tocilizumab, un anticuerpo monoclonal que inactiva IL-6, tiene un efecto rápido de resolver la toxicidad, sin reducción en su efecto terapéutico. En ocasiones, el síndrome de liberación de citoquinas puede progresar a hemofagocitosis linfohistiocítica.
Otra toxicidad seria es la encefalitis, caracterizada por confusión, somnolencia y afasia, que puede progresar a convulsiones y edema cerebral. Esta toxicidad no solo puede ocurrir durante el síndrome de liberación de citoquinas, sino hasta 4 semanas después de la infusión de las CAR-T como resultado del tránsito de las células-T por el sistema nervioso central.
Proceso de desarrollo de CAR-T
El proceso de manufactura de CAR-T es personalizado. Como en el caso de Emily, los pacientes tienen que pasar por un riguroso proceso para de esa manera poder:
- Determinar su elegibilidad y beneficio;
- Evaluar su estado clínico, la capacidad de cosechar células-T normales en suficiente cantidad para el proceso de manufactura; y
- Educar al paciente y su familia sobre beneficios y riesgos para que den su consentimiento informado.
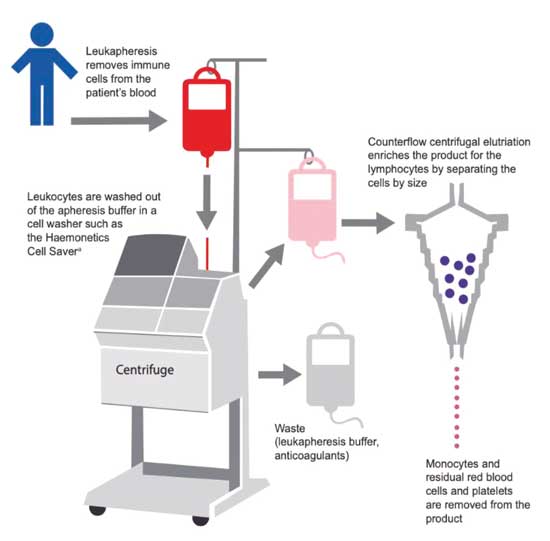
Se debe llevar la enfermedad a su nivel residual más bajo, preservando simultáneamente un número adecuado de células-T normales a ser cosechadas utilizando leucoféresis (Figura 2), y se verifica la calidad y cantidad del producto obtenido para comenzar el proceso de manufactura.
La células-T son modificadas utilizando un vector, ya sea un transposoma o un vector viral, para otorgarle especificidad antigénica antitumoral –antileucémica– (Figura 3). Se vislumbra que la tecnología CRISP CAS9 permita hacer la modificación sin utilizar un vector viral y precisar el lugar de incorporación en el ADN, minimizando el riesgo de oncogénesis. Luego del proceso de manufactura, se evalúa el producto para determinar su calidad con el fin de ser reinfundido al paciente.
El complejo y sofisticado proceso de manufactura y el hecho de ser personalizado hacen que tenga un costo extremadamente elevado (cientos de miles de dólares), sin contar con los gastos de hospitalización y el proceso de aféresis. Por eso, se viene buscando la forma de abaratar los procesos para que todo paciente afectado que lo requiera pueda beneficiarse con esto.
Comentario
Se espera a corto plazo que las CAR-T jueguen un rol importante en mejorar la prognosis de los pacientes con leucemia linfática aguda y con alto riesgo de progresar con tratamiento convencional, sobre todo los que, luego del periodo de inducción de remisión, continúen con un nivel alto de células leucémicas residuales. Se investiga sobre el control de los efectos secundarios agudos preservando su efectividad, modificando las células CAR-T y dilucidando los mecanismos de toxicidad. No hay duda de que las células CAR-T tendrán un papel protagónico en el tratamiento de la leucemia linfocítica, al igual que en otros tipos de malignidades.
Referencias
- Fesnak AD, June CH, Levine BL, Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer 2016;16(9):566-581.
- Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T-cell therapy-assessment and management of toxicities. Nat. Rev. Clin Oncol 2018;15(1);47-62.








