Abreviaciones: AMH, anti-Müllerian hormone;…

Yaniris García Cruz, MD
Endocrinóloga
Abreviaciones:
AMH, anti-Müllerian hormone; DHEAS, dehydroepiandrosterone; FSH, follicle stimulating hormone; GnRH, gonadotropin-releasing hormone; GWA: Genome-wide association; LH, luteinizing hormone; mFG, modified Ferriman-Gallway; PCOS, polycystic ovary syndrome; SHBG, sex hormone binding globulins
Introducción
El síndrome de ovario poliquístico (SOP) o también conocido como PCOS, por sus siglas en inglés, es la condición endocrina más común en las mujeres de edad reproductiva, afectando entre el 8% y el 13% de esta población. No obstante, es una condición que enfrenta muchos retos en su diagnóstico, lo que conlleva un retraso en su tratamiento.
Las mujeres afectadas por el SOP están en mayor riesgo de complicaciones metabólicas, psicológicas y reproductivas, por lo que la detección e intervención temprana es de suma importancia.
Fisiopatología
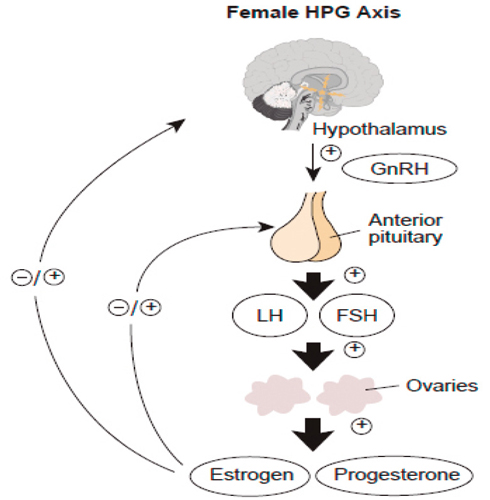
La patogénesis del SOP es multifactorial e incluye componentes genéticos, ambientales y transgeneracionales, los cuales alteran las señales del eje hipotálamo-hipófisis-ovario promoviendo el hiperandrogenismo ovárico y suprarrenal.
La mayor fuente de andrógenos proviene de los ovarios. El eje hipotálamo-hipófisis-ovario se ve afectado por una anormalidad intrínseca, aumentando la amplitud de los pulsos de GnRH, lo que favorece la secreción de LH sobre FSH. Tener un FSH relativamente inferior a LH causa una disminución en la maduración de los folículos, causando anovulación. El aumento preferencial de LH estimula la producción de testosterona por las células de la teca en los ovarios.
La resistencia de insulina tiene un rol importante en el SOP, ya que la insulina actúa sinérgicamente con LH estimulando la secreción de andrógenos en los ovarios. También disminuye la producción de globulinas transportadoras de hormonas sexuales (SHBG) en el hígado, lo que resulta en un aumento de testosterona libre en la circulación. Estudios recientes han mostrado que un nivel elevado de la hormona anti-Mülleriana (AMH) promueve la activación de las neuronas GnRH y el inicio del SOP.
Los estudios en animales y los datos humanos muestran que este síndrome tiene orígenes transgeneracionales, con un riesgo 5 veces mayor en hijas nacidas de madres con SOP. Aunque el mecanismo de cómo las hijas están expuestas a los andrógenos durante el embarazo no está claro, se piensa que la AMH está involucrada. Un estudio en ratones demostró que cuando el feto está expuesto a altos niveles de AMH durante el segundo y tercer trimestre, produce el desarrollo de SOP en la cría causando altos niveles de LH y andrógenos.
Se ha hecho evidente que este síndrome incluye componentes genéticos. En efecto, los estudios de asociación del genoma (GWA) han identificado un total de 19 locus de genes de riesgo para SOP localizados en las vías neuroendocrinas, metabólicas y reproductivas.
El diagnóstico y sus retos
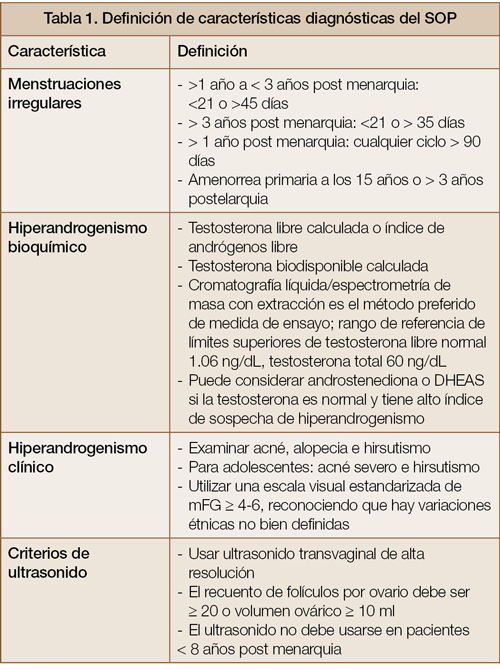
No existe una prueba diagnóstica específica para establecer el diagnóstico del SOP. Este diagnóstico se basa en la presencia de al menos 2 de 3 de los siguientes criterios, conocidos como los criterios de Rotterdam:
- Oligo-anovulación crónica;
- Hiperandrogenismo (clínico y/o bioquímico); y
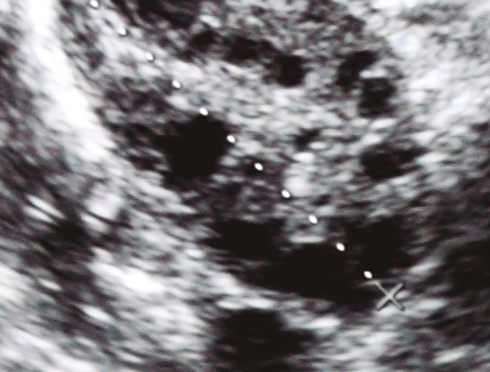
- Ovarios con morfología poliquística.
En casos donde se presentan menstruaciones irregulares e hiperandrogenismo, no hay necesidad de realizar un sonograma para establecer el diagnóstico. En la Tabla 1 se describen en detalle las características que deben tomarse en consideración para realizar el diagnóstico.
Es importante recalcar que el SOP es un diagnóstico de exclusión. Por ello, otras condiciones como enfermedad tiroidea, hiperprolactinemia e hiperplasia suprarrenal congénita no clásica deben ser descartadas midiendo niveles de TSH, prolactina y 17-hidroxiprogesterona (17OHP), respectivamente. Un valor de 17OHP sobre 10 ng/mL confirma la deficiencia de 21-hidroxilasa, mientras que un valor entre 2 a 10 ng/mL sugiere la necesidad de realizar una prueba confirmatoria de estimulación con hormona adrenocorticotrópica. En pacientes con otras manifestaciones atípicas, se debe descartar hipogonadismo hipogonadotrópico o enfermedad de Cushing. Si hay un cuadro androgénico más severo, se debe descartar tumores secretores de andrógenos.
Consecuencias y tratamiento
El manejo del SOP es multidisciplinario, con énfasis en el control de comorbilidades metabólicas como la obesidad, la diabetes mellitus tipo 2, la hipertensión y la dislipidemia, así como de los síntomas asociados al SOP, como oligo-anovulación e hirsutismo. En adición, los desórdenes psiquiátricos como la depresión, la ansiedad, la angustia por la imagen corporal y los trastornos alimenticios deben formar parte del cribado, ya que su prevalencia es alta en esta población.
La primera línea de intervención es la modificación del estilo de vida. Se ha visto que la pérdida de peso hasta de un 5% tiene un efecto positivo en el hiperandrogenismo, en las características metabólicas, en las irregularidades en el ciclo menstrual y en la calidad de vida. En cuanto a la terapia médica, los anticonceptivos orales (ACOs) son efectivos para tratar tanto los ciclos menstruales irregulares como el hirsutismo y el acné. Cualquier combinación de estrógeno-progestina se puede utilizar según la preferencia de la paciente, tomando en cuenta el perfil de efectos secundarios y el cumplimiento. Es importante saber que, según lo recomendado por la Organización Mundial de la Salud, la preparación de estrógeno 35µg con acetato de ciproterona se debe usar solo como segunda línea en casos de persistencia de hirsutismo y acné, ya que tiene un alto riesgo de eventos tromboembólicos.
El uso de monoterapia con metformina tiene un efecto leve a moderado en cambios en la regularidad de los ciclos menstruales e hiperandrogenismo, y es inferior a los ACOs; pero en casos en que la paciente no tolere los ACOs, es una opción. Las nuevas guías recomiendan el uso combinado de metformina con ACOs, mayormente en pacientes con sobrepeso y obesidad, ya que así ayuda a disminuir la resistencia a la insulina.
El uso de antiandrógenos, como espironolactona y finasterida, se recomiendan como segunda línea para controlar el hirsutismo. Es importante que se utilice un método contraceptivo efectivo en conjunto con los antiandrógenos, ya que son teratogénicos. Además, poseen el riesgo de feminizar el feto masculino en caso de que se utilice inadvertidamente durante el embarazo. La flutamida, otro antiandrógeno, no se recomienda por su alto riesgo de hepatotoxicidad aun con mínimas dosis.
La mayor implicación asociada a la disfunción ovulatoria es la infertilidad. En adición, cuando esta se asocia a otras características de SOP como la obesidad, también se relaciona con una alta prevalencia de hiperplasia y cáncer endometriales. El uso de anticonceptivos orales puede ser útil para reducir el riesgo de cáncer endometrial. En términos de fertilidad, se recomienda el uso de letrozol como terapia de primera línea sobre el citrato de clomifeno, ya que este está asociado a más embarazos y mejora la tasa de nacidos vivos. Antes de comenzar con letrozol, se debe orientar a la paciente sobre el hecho de que su uso no está aprobado por la Administración de Drogas y Alimentos de los Estados Unidos (FDA); para este propósito, existe una alternativa disponible (citrato de clomifeno). Cuando se compara el uso de metformina versus placebo, se ha visto una mejoría modesta en cuanto a la ovulación y a la taza de nacidos vivos. El uso de gonadotropinas se considera de segunda línea cuando se busca fertilidad.
Conclusión
El enfoque del SOP debe incluir la educación a la paciente sobre las implicaciones metabólicas, además de las reproductivas, un cuidado multidisciplinario y modificaciones en estilos de vida. El diagnóstico y el manejo de las pacientes con SOP constituyen un reto, por lo que establecer el diagnóstico adecuado e intervenir de una manera temprana es importante para evitar complicaciones y mejorar la calidad de vida de nuestras pacientes.
Referencias
- Hoeger KM, Dokras A, Piltonen T. Update on PCOS: Consequences, Challenges, and Guiding Treatment. The Journal of Clinical Endocrinology & Metabolism. 2021; 106(3): 1071–1083.
- Teede HJ, Misso ML, Costello MF, et al.; International PCOS Network. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Clin Endocrinol (Oxf). 2018; 89 (3): 251-268.
- Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E; American Association of Clinical Endocrinologists (AACE); Association of Clinical Endocrinologists (AACE), American College of Endocrinology (ACE), and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome -Part 1. Endocrine Practice. 2015;21 (11): 1291-1300.
- Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E; American Association of Clinical Endocrinologists (AACE), American College of Endocrinology (ACE), and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the Best Practices in the Evaluation and Treatment of Polycystic Ovary Syndrome – Part 2. Endocrine Practice. 2015; 21 (12): 1415-1426.