¿Existe el cáncer de próstata verdaderamente andrógeno independiente?

Eduardo Canto, MD
Urólogo,
Ashford Medical Center, Suite 109
787.725.6278
Reemplazo de orquiectomía y estrógenos
Hasta 1985, cuando la FDA aprobó el leuprolide (Lupron®), el primer agonista del receptor de la hormona liberadora de la hormona luteinizante (LHRH), los pacientes de cáncer de próstata avanzado eran tratados con orquiectomía o dosis altas de estrógeno, tal como lo hacía el Dr. Huggins. Los agonistas de LHRH, al dar un estímulo constante al receptor de LHRH, en vez del estímulo pulsátil fisiológico, paradójicamente resultaban en la inhibición de la producción de hormona luteinizante y, como consecuencia, producían una “castración química” usualmente reversible. Al ser preferido por los pacientes, el uso de agonistas de LHRH reemplazó a la orquiectomía.
El uso rutinario del PSA para la detección temprana ha generado que la mayoría de casos de cáncer de próstata se detecten en estados mucho menos avanzados que antes de la década de 1980 y que hayan desaparecido los casos de compresión del cordón espinal por metástasis a hueso que se veían en las salas de emergencia. El alto riesgo de trombosis venosa que conlleva el uso de estrógenos, así como la introducción de flutamid (Eulexin®) en 1989 y de docetaxel (Taxotere®) en 2004 como tratamiento “andrógeno independiente” pusieron en desuso los estrógenos que tanto beneficiaron a los pacientes del Dr. Huggins.
Una abundancia de terapias nuevas
En la última década ha habido un gran desarrollo de nuevas terapias para el cáncer de próstata avanzado. Solamente en los últimos 4 años la FDA ha aprobado cinco nuevos tratamientos, cada uno con un mecanismo de acción distinto, capaces de prolongar la vida de nuestros pacientes.
En 2010 se aprobó la primera inmunoterapia, sipuleucel-T (Provenge®), y se aprobó cabazitaxel (Jevtana®), un derivado del docetaxel, que es menos susceptible a la exportación de la célula de cáncer mediada por la glucoproteínaP. En 2013 se aprobó radium-223 (Xofigo), un fármaco radioactivo de muy corto alcance con afinidad para las metástasis a hueso. Sin embargo, han sido dos terapias las que mayor impacto han tenido en el tratamiento de cáncer de próstata resistente a castración: abiraterone (Zytiga®) y enzalutamide (Xtandi®), que paradójicamente inhiben la producción de testosterona y el receptor de testosterona, respectivamente.
Con la aprobación de abiraterone en 2011 y de enzalutamide en 2012 para pacientes postquimioterapia, y de abiraterone en diciembre de 2012 para pacientes con cáncer resistente a castración que no hubieran recibido quimioterapia, se produjo un cambio importante en el manejo de nuestros pacientes.
El tratamiento usual, limitado en gran parte a quimioterapia con docetaxel al darse la progresión postcastración, ahora cambiaría a tratamiento con abiraterone seguido por docetaxel y, finalmente, enzalutamide, al progresar a pesar de docetaxel.
Terapia contra cáncer de próstata resistente a castración dirigida al receptor de testosterona o a producción de testosterona
En los Estados Unidos, el urólogo Dr. Belldegrun dirigió los esfuerzos clínicos por desarrollar abiraterone, una molécula originalmente creada por científicos en The Institute of Cancer Research en Londres en 1993.
Sin embargo, las bases científicas sobre las que descansan las terapias para cáncer resistente a castración hacia la inhibición de la producción de andrógenos o hacia la inhibición del receptor de la testosterona se remontan a estudios publicados en 1978.
Estos estudios demostraron que las células de cáncer de próstata pueden producir sus propios andrógenos y que estas se hacen resistentes a la castración en parte porque se vuelven más sensitivas a la poca testosterona que queda, a pesar de la castracion2.
El cáncer de próstata que puede desarrollar sin estímulo androgénico
A medida que se ha estudiado a pacientes con progresión del cáncer, a pesar de ser tratados con abiraterone y/o enzalutamide, se han descubierto dos variantes que facilitan la resistencia a estos muy potentes antiandrógenos. Estas son: 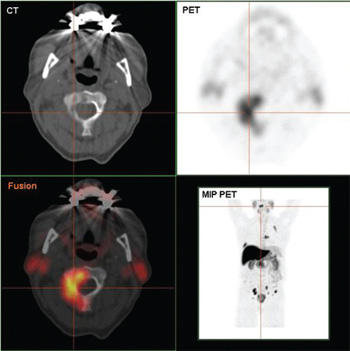
Por lo tanto, el uso del inhibidor ultraeficiente de la producción de testosterona y del inhibidor más potente del receptor de testosterona ha mejorado la calidad de vida y longevidad de estos pacientes, pero también –iatrogénicamente– ha creado células cada vez más independientes del estímulo androgénico.
Referencias -# Huggins, C.; Hodges, C. V., Studies on prostatic cancer: I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. 1941. The Journal of urology 2002, 168 (1), 9-12. -# Mostaghel, E., Steroid hormone synthetic pathways in prostate cancer. Translational Andrology and Urology 2013, 2 (3), 212-227. -# Tan, M. E.; Li, J.; Xu, H. E.; Melcher, K.; Yong, E. L., Androgen receptor: structure, role in prostate cancer and drug discovery. Acta pharmacologica Sinica 2014.











