La terapia molecular dirigida:
Un avance significativo en el manejo de los linfomas
La investigación clínica de los linfomas está evolucionando rápidamente y el campo se dirige cada vez más hacia el uso de las nuevas terapias moleculares. Estos nuevos fármacos son muy activos y tienen menos efectos adversos que la quimioterapia citotóxica. Se espera que en un futuro cercano estas nuevas terapias moleculares sustituirán a la quimioterapia.

Fernando Cabanillas, MD
Hematólogo-Oncólogo
Director, Centro de Cáncer Auxilio Mutuo
Profesor de Medicina, Recinto de Ciencias Médicas UPR
Profesor Adjunto, MD Anderson Cancer Center.
Introducción
Sin duda, en las últimas décadas la quimioterapia ha mejorado enormemente el panorama de los linfomas Hodgkin y no-Hodgkin convirtiéndolos en trastornos potencialmente curables. Sin embargo, los efectos adversos asociados a la quimioterapia infunden una gran aprensión y temor en la mayoría de pacientes.
Esto podría cambiar en un futuro no muy lejano. Al mismo tiempo que desarrollábamos la quimioterapia para linfomas, tras bastidores ocurría una revolución pacífi ca en cuanto al entendimiento de la biología de estos tumores. Gracias a esto, hoy conocemos bien los defectos moleculares responsables de producir estos tumores y de mantenerlos vivos. Esto ha permitido desarrollar nuevas terapias moleculares dirigidas al defecto específi co del tumor, y cada vez hay mayor esperanza de que la terapia biológica pueda sustituir a la quimioterapia citotóxica. Cada tumor tiene una o más mutaciones o anomalías a las que se pueden dirigir las nuevas terapias moleculares.
¿Qué es la terapia molecular dirigida?
La realidad es que para todas las terapias existen una o más moléculas que funcionan de blanco o diana terapéutica; por lo tanto, todas las terapias son moleculares. La diferencia estriba en que en la mayor parte de las terapias existentes la molécula diana no se conocía al momento en que se descubrió la droga, mientras que en la terapia molecular moderna se descubre primero la diana y luego se diseña el tratamiento. Ya que la diana (el blanco terapéutico) se selecciona de antemano, la terapia es usualmente más específi ca al defecto molecular del tumor. Por lo tanto, la terapia moderna molecular dirigida es menos tóxica que las quimioterapias tradicionales, cuyas dianas son menos específi cas. En esencia, hay dos clases de terapia molecular: los anticuerpos monoclonales y las moléculas pequeñas inhibidoras.
Anticuerpos monoclonales
El nombre genérico de los anticuerpos monoclonales contiene al fi nal las letras “mab” que indican que es un monoclonal antibody (ejemplo: rituximab). Estos se pueden dividir en 3 categorías.
La primera categoría agrupa aquellos anticuerpos que funcionan como inmunoterapia al identifi car una proteína o antígeno de la superfi cie de la célula maligna y, así, activan el sistema inmune que entonces es capaz de eliminar esas células tumorales. El mejor ejemplo es el rituximab (Rituxan). Contrariamente a lo que muchos piensan, el primer anticuerpo monoclonal efectivo en linfomas no fue el rituximab (1991), sino el alemtuzumab (Campath), descubierto en la década de 1980. Este se dirige hacia el antígeno CD52 presente en la superfi cie de casi todos los linfocitos normales y malignos, incluyendo los linfocitos B, T y NK. Debido a su efi cacia en eliminar los linfocitos –tanto normales como malignos– este fármaco es capaz de producir remisiones excelentes, pero está limitado por la toxicidad causada por la supresión universal del sistema inmune, tanto humoral como celular. Por eso son comunes las infecciones con citomegalovirus, tuberculosis, pneumocistis carini y herpes zoster, por lo que se requiere una vigilancia extrema para detectarlas temprano o evitarlas con profi laxis. El rituximab, sin embargo, es menos tóxico porque solo elimina linfocitos B normales junto con los malignos que expresan el antígeno CD20 en su superfi cie. La mayoría de los linfomas no-Hodgkin se derivan de los linfocitos B que casi siempre son CD20+ y responden bien al tratamiento con rituximab sin mayores complicaciones, con excepción de algunos casos de hipogamaglobulinemia.
La segunda categoría de anticuerpos monoclonales consiste en aquellos que se combinan con una molécula altamente tóxica que es dirigida por el anticuerpo hacia el interior de la célula tumoral. Al dirigir la molécula tóxica hacia la célula tumoral se protege a las células normales de la toxicidad, eliminando así casi exclusivamente las células tumorales. El mejor ejemplo de esto es el brentuximab vedotin (Figura 1), un anticuerpo contra la proteína CD30 (expresada en la superfi cie de algunos linfomas Hodgkin y de los linfomas anaplásicos de células grandes). Ya que las células Reed Sternberg expresan CD30 en su superfi cie, esto las hace susceptibles al ataque por este anticuerpo monoclonal conjugado.
Figura 1.
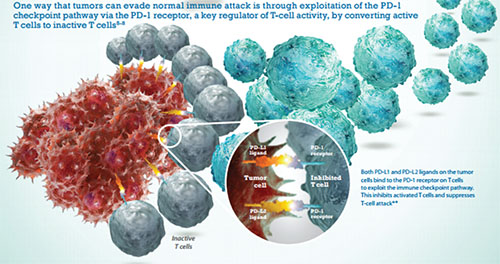
La tercera categoría agrupa a los anticuerpos que actúan al bloquear procesos normales, como el de los puntos de control (checkpoints) del sistema inmune, un muy importante y reciente descubrimiento. Estos puntos de control evitan que el sistema inmune se active en contra de sí mismo, lo cual resultaría en trastornos autoinmunes. El sistema normalmente tiene puntos de control, cuyo rol es amortiguar la activación de los linfocitos T, lo que llamamos checkpoint inhibition o inhibición de los puntos de control que existen mayormente para evitar los trastornos autoinmunes. De alguna forma los tumores han logrado utilizar este proceso normal de inactivación del sistema inmune para su benefi cio, disminuyendo la capacidad del huésped de atacar el tumor. En esta tercera categoría, el anticuerpo se interpone entre dos moléculas involucradas en la inhibición como por ejemplo el PDL-1 en la superfi cie de la célula tumoral y el PD-1 expresado en los linfocitos T (Figura 2). Dos ejemplos de drogas que funcionan a través de este mecanismo son nivolumab y pembrolizumab.
Figura 2.
Moléculas pequeñas inhibidoras
A diferencia de los anticuerpos monoclonales, estas moléculas son mucho más pequeñas. Al fi nal de su nombre genérico llevan las letras “ib” que signifi can inhibidores. El primero precursor de estas drogas fue el imatinib (Gleevec) para leucemia crónica mielógena que ha cambiado radicalmente el pronóstico de los pacientes con esta enfermedad. Estas drogas son diseñadas para interferir con el proceso de señalización intracelular bloqueando algunas moléculas cruciales en este proceso.
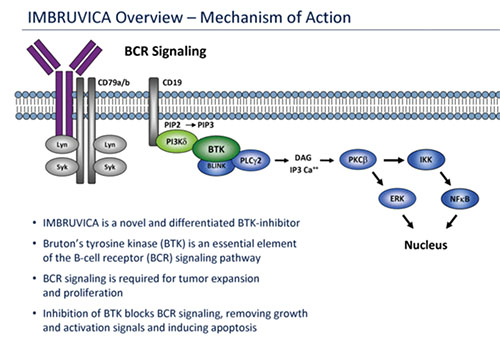
En linfomas el mejor ejemplo es la droga ibrutinib (Imbruvica) que bloquea la molécula tirosina quinasa de Bruton, importante en la conducción de señales intracelulares de los linfocitos B normales y malignos (Figura 3). Esta droga es capaz de producir respuestas al tratamiento en linfomas del manto previamente tratados en un 68%; en un 21% las remisiones fueron completas. En leucemia crónica linfocítica y en otros linfomas no-Hodgkin también han ocurrido respuestas significativas.
Figura 3.
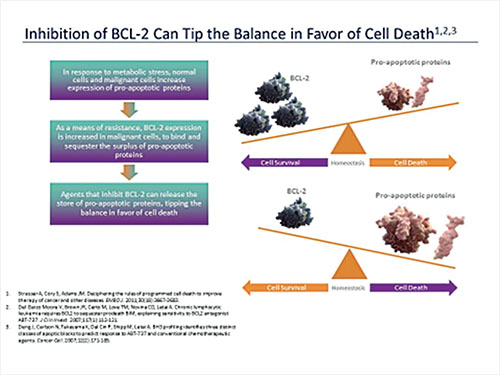
Entre las moléculas pequeñas inhibidoras bajo estudio, una de las más prometedoras es venetoclax, una droga capaz de inhibir bcl-2. Bcl-2 es una proteína que inhibe la apoptosis o muerte celular programada de algunas células malignas, como la de los linfomas foliculares y de la leucemia crónica linfocítica (LCL). La inhibición de bcl-2 promueve la muerte celular al cambiar el balance a favor de las moléculas proapoptóticas que inducen la muerte de las células malignas (Figura 4).
Esta droga acaba de recibir la aprobación de la FDA para leucemia crónica linfocítica con mutación del gene p53, lo que usualmente signifi ca que son células resistentes a la quimioterapia. Tan prominente pueden ser las respuestas a esta droga que el síndrome de lisis tumoral es una de las complicaciones frecuentes y hay que tomar medidas para evitarlo. Ya se han observado respuestas muy positivas en un 40% de casos con linfoma de células grandes en recaída y en un 83% de linfomas foliculares en recaída.
Linfomas no-Hodgkin
Varias de estas drogas han jugado y siguen jugando un papel muy importante en el tratamiento. El rituximab se usa prácticamente en todos los linfomas de células B, la mayoría de las veces en combinación con quimioterapia. Su impacto ha sido enorme. Ibrutinib ha sido muy efectivo en el tratamiento de segunda línea de linfomas de células del manto, en macroglobulinemia de Waldenstrom y en leucemia crónica linfocítica, para las cuales ya está aprobado por la FDA. También tiene actividad en linfomas de células grandes B del tipo ABC y en linfomas foliculares. Se está investigando en combinación con quimioterapia para linfomas de células grandes B del tipo ABC, que tienen un peor pronóstico.
En los linfomas anaplásicos, que siempre expresan el antígeno CD30, el brentuximab se está usando mayormente como terapia de segunda línea en casos que fallan a la quimioterapia.
Actividad en linfoma de Hodgkin
Las células malignas, las llamadas Reed-Sternberg de los linfomas Hodgkin, tienen la peculiaridad de que expresan prominentemente la molécula PD-L1 en su superfi cie, importante inhibidor del punto de control inmune y capaz de amortiguar o inactivar las células T. Así, paralizan el ataque del sistema inmune contra el linfoma Hodgkin. Estudios recientes con inhibidores de los puntos de control (nivolumab y pembrolizumab) han demostrado respuestas del 66% al 87% en pacientes en recaída luego de haber recibido tratamiento con quimioterapia citotóxica.
Terapia molecular versus quimioterapia
En vista de la gran actividad antitumoral de nivolumab y pembrolizumab en casos de linfoma Hodgkin, al igual que las prominentes respuestas con brentuximab vedotin, se está investigando ya la combinación de estas dos drogas con la esperanza de que puedan producir respuestas antitumorales equivalentes a la quimioterapia, pero con menos efectos tóxicos. De poder demostrarse su equivalencia a la quimioterapia, los primeros pacientes que podrían benefi ciarse de la combinación de esta terapia molecular serían aquellos con linfoma Hodgkin.