ONCOLOGÍA: SUPLEMENTO DE LEUCEMIA
Leucemia mieloide aguda:
Nuevas alternativas de tratamiento y una mayor esperanza de vida

Edgardo L. Santiago Guzmán, MD
Hematólogo-Oncólogo
Catedrático Auxiliar, Escuela de Medicina,
Universidad de Puerto Rico
New Horizons Hematology & Oncology Group
Hospital del Maestro Suite 2002
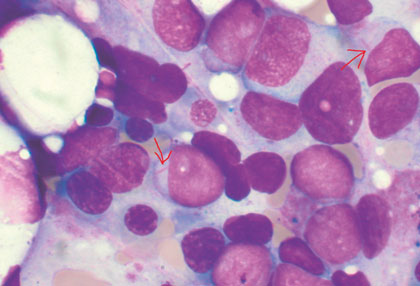
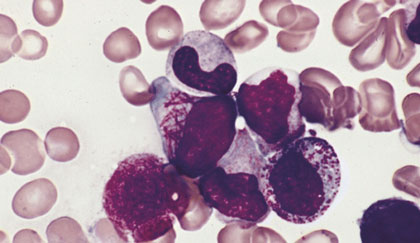
La leucemia mieloide aguda (LMA) es una malignidad de la sangre que se origina en la médula ósea. En condiciones normales, la médula ósea produce unas células denominadas mieloblastos que, tras madurar, se convierten en granulocitos. Los granulocitos juegan un rol sumamente importante en la defensa del organismo contra las infecciones. En la LMA, los mieloblastos pierden la capacidad de maduración causando una proliferación anormal y desproporcionada de estas células en la médula ósea. Este incremento de mieloblastos interfiere con la producción de células normales de la sangre, tales como los glóbulos blancos, la hemoglobina y las plaquetas.
La LMA es la leucemia aguda más común en adultos, siendo los 67 años la edad promedio al diagnóstico. La LMA es un poco más común en los hombres, pero el riesgo promedio de por vida para ambos sexos es del 0.5 al 1%. En general, con los tratamientos convencionales, la probabilidad de estar vivo a 5 años del diagnóstico es del 35%. Si la LMA no es tratada con prontitud, la mortalidad ocurre en el 100% de los casos.
El intervalo entre la aparición de los primeros síntomas y el diagnóstico es habitualmente inferior a 3 meses debido al carácter agudo de la enfermedad. Los síntomas de los pacientes con LMA son consecuencia del déficit de glóbulos rojos (sensación de cansancio, debilidad, mareos, palidez); del déficit de plaquetas (hematomas, hemorragias de encías, nasales o de cualquier otro foco); y del déficit de granulocitos (fiebre e infecciones). En ocasiones, puede observarse el crecimiento de los ganglios linfáticos, del hígado o del bazo.
Diagnóstico
Para el diagnóstico de la LMA, se requieren estudios básicos en sangre periférica y de la médula ósea (más del 20% de mieloblastos, excepto en alteraciones citogenéticas de buen pronóstico). Además, se deben realizar estudios citogenéticos (para detectar anomalías cromosómicas) y moleculares (para detectar alteraciones génicas), fundamentales para tipificar y clasificar la enfermedad.
La mayoría de las alteraciones en los cromosomas o genes relacionados con la LMA se adquieren durante la vida de la persona en lugar de heredarse antes del nacimiento. Algunas de estas alteraciones pueden obedecer a causas externas, como la exposición a radiaciones o a productos químicos, pero en la mayoría de los casos no están claras las razones por las que suceden. Muchas de estas anormalidades génicas probablemente son eventos al azar que ocurren en el interior de una célula, sin que haya una causa externa. Estos parecen ocurrir con mayor frecuencia a medida en que envejecemos, lo que podría ayudar a explicar por qué la LMA usualmente se presenta en personas de edad avanzada.
Clasificación
La LMA se clasifica según las alteraciones cromosómicas o génicas encontradas al realizar el diagnóstico. Esta clasificación es de suma importancia ya que permite determinar el pronóstico y, de esta manera, elegir el tratamiento más efectivo para cada caso.
Las LMA con translocación entre los cromosomas 8 y 21, la inversión en el cromosoma 16 y la translocación entre los cromosomas 15 y 17 son categorizadas como leucemias con buen pronóstico. La LMA t(15;17) por lo general cuenta con una alta probabilidad de cura y su tratamiento suele ser diferente al de los otros tipos de LMA. Por el contrario, las leucemias que posean mayor o igual a 3 anormalidades cromosómicas, deleción en alguno de los brazos del cromosoma 5 o 7 son denominadas leucemias de pobre pronóstico por su gran probabilidad de resistencia al tratamiento y su alta tasa de recaídas.
Uno de cada tres pacientes con diagnóstico de LMA tendrá una citogenética normal (sin alteraciones a nivel de los cromosomas).
En estos casos, la condición es causada por alteraciones a nivel de algunos genes como:
- NPM1 (buen pronóstico);
- FLT3 (pobre pronóstico, incidencia del 30%);
- DNMT3A (pobre pronóstico);
- CEBPA (buen pronóstico);
- IDH1 (pobre pronóstico, incidencia del 6-10%); y
- IDH2 (pobre pronóstico, incidencia del 12%).
Las proteínas codificadas a partir de estos genes tienen diferentes funciones en la célula, pero la mayoría de ellas están involucradas en la regulación de procesos como el crecimiento, la proliferación, la diferenciación y la supervivencia celular.
En ocasiones, la LMA es la etapa final de alguna enfermedad hematológica, como los síndromes mielodisplásicos o los síndromes mieloproliferativos crónicos. También puede ser causada por tratamientos previos con quimioterapia y/o radioterapia que fueron implementados para tratar otra malignidad previa. Ambas etiologías están asociadas a pobre pronóstico.
Opciones terapéuticas
Inducción
La inducción con quimioterapia intravenosa es la primera fase del tratamiento y está dirigida a deshacerse de tantas células leucémicas como sea posible. La intensidad del tratamiento puede depender de la edad de la persona, de las comorbilidades y del estado funcional. Los especialistas suelen administrar la quimioterapia más intensa a personas menores de 60 años, pero algunos pacientes de edad avanzada con buena salud pueden beneficiarse de un tratamiento similar.
El régimen comúnmente utilizado para la inducción se conoce como 7 + 3. Este consiste en administrar citarabina continuamente por 7 días junto a infusiones cortas de antraciclina (daunorubicina o idarubicina) cada uno de los primeros 3 días. En agosto de 2017, se aprobó para la inducción un medicamento que contiene una dosis fija y liposomal de daunorubicina con citarabina (Vyxeos) al demostrar una supervivencia global estadísticamente significativa en pacientes con leucemias secundarias a tratamientos previos con quimioterapia o cuando la leucemia fue causada por la progresión de un síndrome mielodisplásico o mieloproliferativo crónico.
A consecuencia de la inducción, los pacientes desarrollan contajes de células sanguíneas peligrosamente bajos necesitando por eso antibióticos y transfusiones de productos sanguíneos por cerca de un mes. Se estima que la probabilidad de muerte debido a complicaciones durante la inducción es entre un 3 a un 5%.
Se considera que una inducción ha sido exitosa cuando se logra una remisión completa (< 5% de mieloblastos en la médula ósea y contajes normales en el hemograma). Las tasas de remisiones completas luego de una inducción rondan entre un 60 y un 80%.Consolidación
Luego de alcanzar una remisión completa, se administra un tratamiento adicional llamado consolidación, para ayudar a prevenir una recaída (recurrencia). La citarabina en altas dosis es el agente de quimioterapia comúnmente utilizado para la consolidación. El trasplante de médula ósea alogénico debe implementarse como consolidación en las leucemias categorizadas como de pobre pronóstico al momento del diagnóstico. El trasplante de médula ósea también debe ser el tratamiento de elección en pacientes con LMA en recaída, luego de haber alcanzado una segunda remisión completa.
En septiembre de 2020 se aprobó el mantenimiento con azacitidina oral en pacientes que recibieron terapia de inducción y lograron una primera remisión completa pero por alguna razón ya no son candidatos a seguir recibiendo tratamientos agresivos con intento curativo tales como una consolidación con terapia citotóxica o trasplante de médula ósea.
En los últimos años, el tratamiento convencional de LMA ha evolucionado y gracias a nuevos estudios se han aprobado medicamentos que actúan directamente en alteraciones génicas específicas. Entre estos medicamentos están los siguientes:
Inhibidores de FLT3
La midostaurina (Rydapt) se aprobó en abril de 2017 para administrarse en combinación con quimioterapia en pacientes de LMA con la mutación FLT3 que no habían recibido tratamientos previos. En un estudio clínico, mejoraron significativamente la supervivencia global y la supervivencia libre de eventos, disminuyendo así la probabilidad de muerte en un 22%. Otros inhibidores de FLT3 que han demostrado eficacia luego de recaída o en LMA refractarias (inhabilidad para alcanzar remisión) son quizartinib, crenolanib y gilteritinib.
Inhibidores de IDH
Los inhibidores de IDH pueden ayudar a las células de leucemia a madurar a células sanguíneas normales. Algunos de estos medicamentos son el enasidenib (Idhifa) y el ivosidenib (Tibsovo). El enasidenib es un inhibidor selectivo de IDH 2 y fue aprobado en agosto de 2017 al demostrar una tasa de respuesta objetiva de un 40.3% y una supervivencia global media de 9.3 meses en pacientes en recaída y/o refractarios a tratamientos previos. El ivosidenib es un inhibidor selectivo de IDH 1 y fue aprobado en julio de 2018, ya que demostró una tasa de respuesta objetiva de 41.6% y una tasa de respuestas completas del 21% en pacientes en recaída y/o refractarios a tratamientos previos. Ambos medicamentos también se encuentran aprobados como primera línea en pacientes con mutaciones específicas en IDH que no son candidatos a tratamiento intenso.
Anticuerpos monoclonales
Estos están diseñados para atacar objetivos específicos que se encuentran en la superficie de las células malignas. La ozogamicina gemtuzumab (Mylotarg) es un anticuerpo monoclonal dirigido a atacar las células de leucemia positivas para CD33. Este medicamento fue aprobado en septiembre de 2017 en combinación con quimioterapia para pacientes que no habían sido previamente tratados y como monoterapia en aquellos en recaída o enfermedad refractaria.
Inhibidores de BCL-2
El venetoclax (Venclexta) ha sido uno de los medicamentos más comentados durante los últimos años para diversos tipos de malignidades hematológicas. Obtuvo una aprobación acelerada en noviembre de 2018 para utilizarlo en combinación con azacitidina, decitabine o bajas dosis de citarabina en pacientes con LMA que no habían sido previamente tratados, mayores de 75 años o en aquellos que, por sus comorbilidades, se excluyeron de recibir una inducción agresiva con quimioterapia. La combinación de venetoclax con decitabina alcanzó una tasa de respuestas completas de un 54% y una tasa de respuesta objetiva de un 75%. Sin duda alguna, la aprobación de este régimen ha revolucionado el tratamiento de LMA, ya que gran parte de los pacientes diagnosticados con esta condición no están aptos para tolerar una inducción con quimioterapia.
Otros tratamientos
Otras terapias muy prometedoras que aún se encuentran bajo investigación están destinadas a que el sistema inmunológico del paciente sea el responsable de combatir la leucemia. Entre estas, se encuentran los inhibidores de los puntos de cotejo del sistema inmunológico y las terapias de células T (juegan un rol crucial en el sistema inmunológico) con CAR (receptores quiméricos de antígenos). Los inhibidores de los puntos de cotejo se encargan de impedir que el sistema inmunológico sea inactivado por el tumor para que, de esta manera, este sea atacado constantemente.
Por otro lado, en la terapia de células T con CAR se extraen las células T de la sangre del paciente y luego se alteran en el laboratorio para que tengan sustancias específicas que les permitirán identificar y adherirse a las células de la leucemia para su destrucción. Como último paso, estas células T manipuladas se infunden de regreso en la sangre del paciente para que puedan ejecutar su misión.
Comentario
En los últimos años, el tratamiento para la LMA ha dado un paso gigante y se vislumbra que los agentes que están bajo investigación tengan resultados alentadores, para así aportar significativamente en el control y la posible cura de esta temible y mortal condición.
Referencias
- Masarova L, Kantarjian H, Garcia-Mannero G, Ravandi F, Sharma P, Daver N. Harnessing the Immune System Against Leukemia: Monoclonal Antibodies and Checkpoint Strategies for AML..Adv Exp Med Biol. 2017;995:73-95. doi: 10.1007/978-3-319-53156-4_4.PMID: 28321813 Review.
- Tiong IS, Wei AH. New drugs creating new challenges in acute myeloid leukemia. Genes Chromosomes Cancer. 2019 Dec;58(12):903-914. doi: 10.1002/gcc.22750. Epub 2019 Apr 11. PMID: 30861214 Review.
- Bazinet A, Assouline S. A review of FDA-approved acute myeloid leukemia therapies beyond ‘7 + 3’. Expert Rev Hematol. 2021 Feb;14(2):185-197. doi: 10.1080/17474086.2021.1875814. Epub 2021 Jan 19. PMID: 33430671
- Venugopal S, Daver N, Ravandi F. An Update on the Clinical Evaluation of Antibody-Based Therapeutics in Acute Myeloid Leukemia. Venugopal S, Daver N, Ravandi F.Curr Hematol Malig Rep. 2021 Feb;16(1):89-96. doi: 10.1007/s11899-021-00612-w. Epub 2021 Feb 25. PMID: 33630233 Review.
- Bose P, Vachhani P, Cortes JE. Treatment of Relapsed/Refractory Acute Myeloid Leukemia. Curr Treat Options Oncol. 2017 Mar;18(3):17. doi: 10.1007/s11864-017-0456-2.PMID: 28286924 Review.