HEMAONCOLOGÍA
Avances en terapia CAR-T:
Innovaciones, aplicaciones clínicas y desafíos futuros
Introducción

Hematólogo Oncólogo
Hospital Auxilio Mutuo
crodriguez@tctoncology.com
La terapia con receptores de antígenos quiméricos de células T, o terapia CAR-T, ha marcado un antes y un después en el tratamiento de diversos linfomas de células B, de leucemia linfocítica aguda de células B (B-ALL) y de mieloma múltiple (MM). Desde la aprobación de las primeras terapias CAR-T por la FDA en 2017 para B-ALL y linfoma difuso de células B grandes (LBCL), el campo ha evolucionado significativamente. Actualmente, contamos con seis productos CAR-T aprobados y múltiples indicaciones terapéuticas (ver Tabla 1). Este artículo explora los avances en la terapia CAR-T, el mecanismo del sistema inmunitario adaptativo frente a los tumores, cómo podemos manipular nuestro sistema inmunitario para erradicar tumores con inmunoterapia, el mecanismo de resistencia tumoral y las futuras direcciones en este campo.
El sistema inmunitario y la inmunoterapia
Para apreciar los avances en la terapia CAR-T, es esencial entender cómo el sistema inmunitario combate el cáncer. La inmunidad adaptativa se subdivide en dos grandes categorías: la respuesta celular y la respuesta humoral, mediadas respectivamente por linfocitos T y linfocitos B. Los linfocitos T son cruciales para la inmunidad celular, mientras que los linfocitos B se encargan de la inmunidad humoral. Dentro de los linfocitos T, existen dos tipos principales: los linfocitos T CD4, que actúan como auxiliares, y los linfocitos T CD8, que son citotóxicos. Estos linfocitos T portan receptores de células T (TCR) que reconocen antígenos presentados por el complejo mayor de histocompatibilidad (MHC). La activación de los linfocitos T CD4 y T CD8 está restringida por el MHC, con TCR que reconocen antígenos en el MHC de clase II para los linfocitos T CD4 y en el MHC de clase I para los linfocitos T CD8. La interacción entre TCR y las células presentadoras de antígenos, junto con señales coestimuladoras como CD28 y 4-1BB, es fundamental para la activación de las células T citotóxicas (CTL).
Receptor de antígeno quimérico (CAR)
El término «quimera» implica la combinación de dos componentes genéticos distintos en un mismo organismo. En la terapia CAR-T, esta quimera se refiere a la integración de un receptor sintético en las células T mediante ingeniería genética. Utilizando vectores virales, se introduce material genético en las células T, que codifica la expresión de un receptor de antígeno específico. Este receptor permite que las células T identifiquen antígenos específicos en los tumores, minimizando el daño a los tejidos sanos.
Estructura del CAR
Un CAR se compone de 3 dominios principales:
- un dominio extracelular,
- un dominio transmembrana y
- un dominio intracelular.
El dominio extracelular incluye un fragmento de cadena única (scFv) derivado de inmunoglobulinas, que se dirige a antígenos extracelulares específicos. La bisagra, compuesta por secuencias de aminoácidos como CD8, CD28, IgG1 o IgG4, proporciona estabilidad. El dominio transmembrana, derivado comúnmente de CD3ζ, CD28, CD4 o CD8α, asegura la funcionalidad del CAR. El dominio intracelular, que incluye uno o más dominios coestimuladores (como CD28 o 4-1BB) y el dominio de activación, es crucial para la proliferación y persistencia de las células CAR-T.
Aplicaciones clínicas y productos aprobados
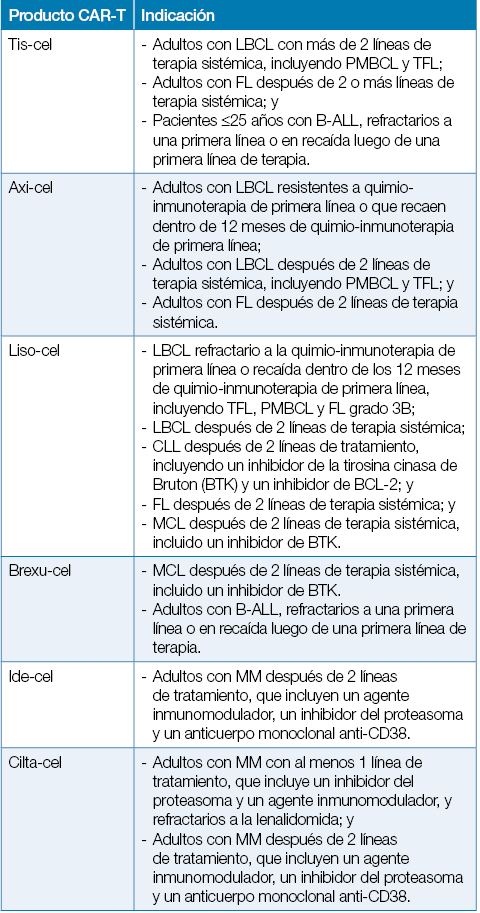
La terapia CAR-T ha sido aprobada por FDA para una variedad de linfomas y leucemias, así como para el mieloma múltiple. La Tabla 1 resume las indicaciones aprobadas por la FDA para los diferentes productos CAR-T, que incluyen tratamientos para LBCL, B-ALL, mieloma múltiple y más.
Producción de CAR-T y transferencia genética
La producción de células CAR-T autólogas comienza con la leucoféresis, que recolecta células T del paciente. Estas células son purificadas, cultivadas, activadas y sometidas a ingeniería genética en un laboratorio especializado. Los vectores virales, como retrovirus y adenovirus, son comúnmente utilizados para introducir el CAR en las células T (proceso de transducción). La fabricación de productos CAR-T aprobados por la FDA toma entre 12 y 30 días, un proceso crítico debido a la necesidad de una respuesta rápida en pacientes con enfermedad activa. En pacientes en recaída o refractarios se puede considerar la terapia puente, utilizando esteroides, quimioterapia y/o radioterapia. La posibilidad de utilizar vectores no virales y nuevos métodos de transducción, como el sistema de transposones de la Bella Durmiente, podría reducir este tiempo a tan solo 2 días, beneficiando a los pacientes con necesidad urgente de tratamiento. Esto último hace necesario validar los datos de seguridad y la eficacia.
Terapia de acondicionamiento previa a las células CAR-T
La linfodepleción (LD) mediante quimioterapia es una fase crucial antes de la infusión de células CAR-T. La fludarabina (25 a 30 mg/m²) y la ciclofosfamida (250 a 500 mg/m²) durante tres días (días -5 a -3 antes de CAR-T) es el régimen más común. Este régimen facilita la expansión in vivo de las células CAR-T, aunque se están explorando regímenes alternativos para mejorar los resultados y reducir efectos secundarios.
CAR-T alogénicos
Los CAR-T alogénicos, derivados de donantes en lugar de ser autólogos, ofrecen ventajas potenciales como la disponibilidad inmediata y la posibilidad de redosificación. Sin embargo, presentan desafíos como el riesgo de enfermedad injerto contra huésped (GVHD) y el rechazo por parte del sistema inmunitario del receptor. Se investigan estrategias para mitigar estos riesgos, como la eliminación del receptor αβ-TCR en las células donantes, el uso de células T de memoria específicas del virus y la depleción de células T mediante anticuerpos anti-CD52.
Desafíos en la terapia CAR-T
Los principales desafíos incluyen la complejidad de la fabricación, la gestión de efectos secundarios y la resistencia tumoral. Los efectos secundarios más comunes son el síndrome de liberación de citocinas (CRS) y el síndrome de neurotoxicidad asociado a células efectoras inmunitarias (ICANS). El CRS puede causar fiebre, hipotensión y daño a órganos, mientras que el ICANS se manifiesta como confusión, convulsiones y edema cerebral. La estrategia para mitigar estos efectos incluye un manejo proactivo y el uso de terapias de soporte.
Direcciones futuras
Las investigaciones actuales y futuras en terapia CAR-T están enfocadas en varias áreas:
- Nuevos productos y ensayos clínicos:
Axi-cel está siendo evaluado en ensayos para LBCL de alto riesgo en primera línea (ZUMA-12), mostrando una tasa de respuesta completa del 86%. Las células CAR-T dirigidas a DdBCMA para mieloma múltiple han mostrado resultados prometedores con una tasa de respuesta global del 100%; - Células CAR-T biespecíficas:
Se están desarrollando células CAR-T que pueden dirigirse a múltiples antígenos tumorales, lo que puede aumentar la eficacia y reducir el riesgo de escape de antígenos; - Desafíos en neoplasias de células T y leucemia aguda mielógena (AML):
Se investiga el uso de células CAR-T contra antígenos similares a los de las células T y el desarrollo de CAR-T para AML, enfrentando obstáculos significativos; y - Terapia de doble focalización:
La combinación de CAR-T dirigidas a CD19 y CD22 puede ser especialmente útil para pacientes con B-ALL, al reducir la probabilidad de escape de antígenos.
Conclusión
La terapia CAR-T ha demostrado ser una herramienta revolucionaria en el tratamiento de ciertos cánceres hematológicos, ofreciendo nuevas esperanzas a pacientes con enfermedades resistentes a tratamientos convencionales. A pesar de los avances, persisten desafíos significativos, incluidos los efectos secundarios y la necesidad de mejoras en la fabricación y tiempos de respuesta. La continua investigación y el desarrollo en este campo prometen optimizar la eficacia de la terapia CAR-T y expandir su aplicabilidad a una gama más amplia de tipos de cáncer, abriendo nuevas oportunidades para la inmunoterapia personalizada.
Referencias
- Depil S, Duchateau P, Grupp SA, et al. Células CAR-T alogénicas «listas para usar». Nat Rev Droga Discov. 2020; 19(3):185–199.
- Locke FL, Ghobadi A, Jacobson CA, et al. Seguridad y actividad a largo plazo del axicabtagén ciloleucel en el linfoma de células B grandes refractario (ZUMA-1). Lancet Oncol. 2019; 20(1):31–42.
- Rafiq S, Hackett CS, Brentjens RJ. Estrategias de ingeniería para superar los obstáculos actuales en la terapia de células T con CAR. Nat Rev Clin Oncol. 2020; 17(3):147–167.
- Zhang C, Liu J, Zhong JF, et al. Ingeniería de células CAR-T. Biomark Res. 2017; 5:22.
- Zhang J, Wang L. El mundo emergente de los ensayos de células TCR-T contra cáncer. Technol Cancer Res Treat. 2019, Jan 1;18.
- Maher J, Davies ET. Targeting cytotoxic T lymphocytes for cancer immunotherapy. Br J Cancer. 2004; 91: 817-821.
- Chavez JC, Dickinson M, et al. 3-year analysis of ZUMA-12.ASH 2023. December 9-12, 2023. Abstract 894.
- Frigault MJ, Rosenblatt J, et al. Phase 1 Study of CART-Ddbcma for the Treatment of Patients with Relapsed and/or Refractory Multiple Myeloma. ASH 2023. December 9-12, 2023. Abstract 894.
- Mailankody S, et al. GPRC5D-Targeted CAR T Cells for Myeloma. N Engl J Med. 2022; 387:1196-1206.
- Fleischer LC, Spencer HT, et al. Targeting T cell malignancies using CAR-based immunotherapy: challenges and potential solutions. J Hematol Oncol. 2019; 12: 141.
















