Bioequivalentes, genéricos y biosimilares:
Un acercamiento al tema desde la perspectiva farmacéutica.

Julio A. Cedeño Alicea, PharmDc 2018, Jorge Duconge Soler, PhD, MSc, BSc Pharm,
Escuela de Farmacia,
Universidad de Puerto Rico, Recinto de Ciencias Médicas
En ciertas ocasiones al entregar una receta en la farmacia, el farmacéutico que nos atiende nos pregunta: “¿Desea el genérico o el bioequivalente?”. Muchas veces respondemos que nos da lo mismo, pues hemos escuchado que “es lo mismo”, pero rara vez hemos pensado en cómo se determina que un medicamento genérico es bioequivalente a otro. Actualmente, 8 de cada 10 recetas (prescripciones) que se despachan son para medicamentos genéricos.
Genérico o bioequivalente
Primero, debemos aclarar que genérico no es lo mismo que bioequivalente. Los medicamentos genéricos se identifican solo por el nombre del ingrediente terapéutico que contienen y no por un nombre de marca registrada. La determinación de su bioequivalencia se basa en el supuesto de que dos productos farmacéuticos son equivalentes o intercambiables terapéuticos cuando la cantidad y la rapidez con la cual se absorben desde la ruta primaria de administración del medicamento que los contiene, haciéndose disponibles en el cuerpo del paciente que los recibe sin mostrar diferencias clínicamente significativas con respecto al medicamento de marca de referencia, luego de ser administrados en la misma dosis y por la misma vía.
Aprobación del medicamento genérico
Para esto, se requiere que el fabricante o su patrocinador someta ante la autoridad regulatoria (por ejemplo, la FDA) una solicitud para desarrollar un protocolo simplificado de aprobación del medicamento genérico denominado ANDA (Abbreviated New Drug Application según lo establecido en la Drug Price Competition and Patent Term Restoration Act, más conocida como Hatch-Waxman Act de 1984). Este protocolo incluye: ruta de administración, dosis y formas iguales a un producto aprobado con anterioridad, estudios de estabilidad, información e indicaciones del ingrediente activo aprobado anteriormente, métodos de análisis, fabricantes del producto terminado, fuentes y especificaciones de materias primas, y pruebas de equivalencia terapéutica con un producto de referencia ya aprobado, como prueba de seguridad y eficacia. Además, todos los sitios de manufactura, empaquetado y ensayos deben cumplir con los mismos estándares de calidad que el medicamento de marca. El objetivo de este protocolo abreviado es reducir los costos de desarrollo, fabricación y registro del medicamento. Además, se espera que este tipo de aplicación no conlleve futuros gastos significativos en mercadeo y publicidad del producto genérico, lo que debe traducirse en una reducción marcada en el precio final del medicamento para el paciente.
El desafío regulatorio de estos estudios consiste en garantizar que es el mismo producto después de cualquier cambio, antes o después de la aprobación del medicamento innovador y para el medicamento genérico, una vez que expiran patentes o cualquier otro derecho de exclusividad. La expectativa es que las biodisponibilidades de dos medicamentos bioequivalentes son tan similares, según se ha demostrado a través de un estudio de bioequivalencia bien diseñado y aprobado por la autoridad regulatoria, que su seguridad y eficacia pueden ser consideradas esencialmente las mismas para la indicación considerada. Esto implica que se requiere aplicar el concepto de biodisponibilidad sistémica, el cual es medido experimentalmente como un criterio sustitutivo (surrogate endpoint) de eficacia y seguridad terapéutica.
Bioequivalencia
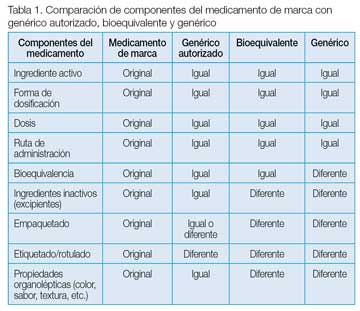
Según la FDA, para que un medicamento sea bioequivalente a otro ya establecido debe ser farmacéuticamente equivalente, lo cual implica: mismo ingrediente activo, misma forma de dosificación, misma dosis, misma ruta de administración y bioequivalencia en términos de biodisponibilidad. El medicamento bioequivalente solo puede diferir del producto de referencia en sus ingredientes inactivos, excipientes, empaquetado, etiquetado, rotulado, mercadeo, forma de presentación y ciertas propiedades organolépticas (color, sabor, textura, etc.; ver Tabla 1). Productos que son terapéuticamente equivalentes se pueden usar de modo intercambiable. De esta manera se garantiza que la sustitución al momento de dispensar un medicamento de prescripción por otro bioequivalente que contiene el o los mismos principios activos, en las mismas dosis molares, para la misma indicación y por la misma ruta de administración, no resultará en un fracaso terapéutico.
Bioequivalentes y equivalencia entre sí
Aclaramos que un producto es bioequivalente a un medicamento establecido, pero que los productos bioequivalentes de un mismo fármaco no son necesariamente equivalentes entre sí. No todos los medicamentos genéricos son bioequivalentes, pues algunos no cumplen con el criterio de biodisponibilidad antes discutido o sencillamente no fueron evaluados a través de un protocolo ANDA. Por consiguiente, aunque por lo general los medicamentos bioequivalentes desarrollados por diferentes fabricantes son genéricos, no todo genérico es un bioequivalente. Se puede obtener más información sobre la bioequivalencia en la siguiente página web de la FDA: http://www.fda.gov/Drugs/ResourcesForYou/Consumers/BuyingUsingMedicineSafely/UnderstandingGenericDrugs/.
Genéricos autorizados
Por último, dentro de la categoría de los genéricos se encuentran los genéricos autorizados, que son mercadeados sin el nombre registrado en su etiqueta. Como consecuencia, el genérico autorizado tiene los mismos componentes –incluyendo forma y color– que el medicamento original, excepto el rotulado (ver Tabla 1). Estos pueden resultar más convenientes para el paciente que está acostumbrado a utilizar el medicamento original, pero, posiblemente, pueden ser adquiridos a un precio menor. En aspectos regulatorios, no es necesario que el manufacturero del medicamento original someta un NDA diferente para su genérico autorizado. Por tal razón, los genéricos autorizados no aparecen en el Orange Book. Se puede obtener una lista de los genéricos autorizados en el siguiente enlace: https://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/UCM183605.pdf.
Referencias
- Chereson R. Bioavailability, Bioequivalence and Drug Selection Chapter 8, Rev. 99.4.25; In: Basic Pharmacokinetics, first edition, by MC Makoid, PJ Vuchetich & UV Banakar, 1999; pp. 8.1 – -8.111
- Davit BM, Nwakama PE, Buehler GJ, Conner DP, Haidar SH, Patel DT, Yang Y, Yu LX, Woodcock J. Comparing generic and innovator drugs: a review of 12 years of bioequivalence data from the United States Food and Drug Administration. Ann Pharmacother. 2009; 43(10):1583-97. doi: 10.1345/aph.1M141.
- Facts about Generic Drugs. US FDA website, 2016. Available at https://www.fda.gov/Drugs/ResourcesForYou/Consumers/BuyingUsingMedicineSafely/UnderstandingGenericDrugs/ucm167991.htm.
- FDA List of Authorized Generic Drugs. US FDA website, 2017; at www.fda.gov/drugs/developmentapprovalprocess/howdrugsaredevelopedandapproved/approvalapplications/abbreviatednewdrugapplicationandagenerics/ucm126389.htm, Accessed on August 2017.
- Kesselheim AS, Misono AS, Lee JL, Stedman MR, Brookhart MA, Choudhry NK, Shrank WH. Clinical equivalence of generic and brand name drugs used in cardiovascular disease: a systematic review and meta-analysis. JAMA 2008; 300(21): 2514-2526.
- Midha, K. K., & McKay, G. (2009). Bioequivalence; Its History, Practice, and Future. The AAPS Journal.
- PL Detail-Document, FAQs About Biosimilars. Pharmacist’s Letter/Prescriber’s Letter. October 2015.
- SAVINGS An Economic Analysis of Generic Drug Usage in the U.S., GPhA, September 2011, page 1.
- Schellekens H, Ryff JC. Biogenerics: the off-patent biotech products. Trends in Pharmacological Sciences 2002; 23(3): 119-121.