Noticias e información médica
Se realizó “Ceremonia de Bata Blanca” en Escuela de Medicina San Juan Bautista.
Los 63 nuevos estudiantes de la Escuela de Medicina San Juan Bautista fueron investidos con su bata blanca, marcando el inicio de sus estudios como futuros médicos. El Dr. Ramón Méndez Sexto–Presidente de la Junta de Licenciamiento y Disciplina Médica de Puerto Rico y graduado de la Primera Clase de Medicina de la Escuela de Medicina San Juan Bautista– fue el orador invitado. Además, la Fundación García Rinaldi y MDF Instruments obsequiaron un estetoscopio a cada estudiante.
El programa MedWay Pre-Med Boot Camp apoya a futuros estudiantes de Medicina.
El programa MedWay Pre-Med Boot Camp “Carving your path in Medicine” ayuda a los estudiantes de pre-Médica a conocer más sobre el amplio campo de la medicina al rotar con médicos en distintas especialidades. En el último programa, participaron 19 estudiantes junto con 20 médicos especialistas, y pudieron así entrar a sala de operaciones, ver pacientes en sala de emergencia, aprender de las distintas modalidades de radiología, asistir a clínicas y hasta rotar en la unidad de stroke en el Hospital Menonita de Caguas. También rotaron en prácticas privadas en pediatría, dermatología, reumatología, neurología, entre otras. Se trata de una experiencia de gran provecho para los futuros médicos.
Completan su especialización 41 médicos en Centro Médico Episcopal San Lucas.
Un grupo de 41 médicos de la Educación Médica Graduada en el Centro Médico Episcopal San Lucas (CMESL) completó su entrenamiento, convirtiéndose en nuevos especialistas. Se trata de una noticia alentadora ante el continuo éxodo de muchos excelentes profesionales a los Estados Unidos. Entre los nuevos especialistas, hay 7 de Medicina Interna, 6 de Pediatría, 7 de Medicina de Emergencia, 4 de Ginecología y Obstetricia, 2 de Cirugía General y 2 de Cardiología. Además, 13 médicos completaron su año transicional. Este programa está acreditado por ACGME y es el programa privado de educación médica graduada más grande de Puerto Rico. La Dra. María Valentín –médica internista y Directora de Educación Médica– informó que más del 60% de los egresados del programa deciden quedarse en Puerto Rico.
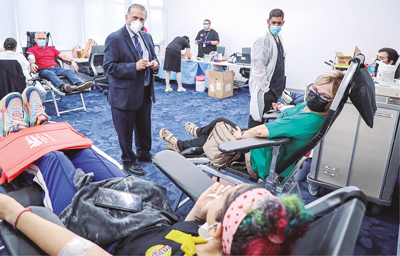
Se realizó primera “Feria de donación de sangre” de la Fundación de Asistencia del Centro de Trauma (FACT) y SIMED.
Para apoyar la promoción de una cultura de donación de sangre, SIMED auspició su primera Feria de Donación de Sangre, en colaboración con la Fundación Asistencia Centro de Trauma (FACT). El Banco de Sangre del Centro Médico movilizó a su personal y equipo a las oficinas de SIMED en Centro Europa, en que se dieron cita empleados y colaboradores de SIMED, parejas, padres con hijos, estudiantes, personal de oficinas de Centro Europa, así como personas motivadas por el llamado en las redes sociales. La Directora Ejecutiva de FACT, Marjorie Stewart-Feria, expresó su agradecimiento a todas las personas que hicieron una donación y a SIMED por el auspicio y la organización.
La FDA aprueba baricitinib (Olumiant®) como primer medicamento para adultos con alopecia areata severa.
La FDA aprobó baricitinib (Olumiant®, Eli Lilly) como tratamiento sistémico para adultos con alopecia areata (AA) severa. La dosis recomendada es de 2 mg/día en pastilla de 2 mg una vez al día. La presentación es en pastillas de 1mg, 2 mg o 4 mg. En casos de respuesta inadecuada o casos severos, se puede subir la dosis a 4 mg/día y, cuando se alcance respuesta adecuada, se puede tratar de bajar la dosis a 2 mg/día. No se recomienda su uso en combinación con otros inhibidores biológicos, inmunomodulares, ciclosporinas, entre otros. La aprobación se basó en los estudios BRAVE-AA1 y BRAVE-AA2 que son estudios fase III por 36 semanas, en 1,200 adultos con alopecia areata severa. Un 17-22% tomando 2 mg y un 32-35% tomando 4 mg lograron 80% o más de cobertura de la calvicie, comparado con un 3-5% con placebo. En www.olumiant.com se puede encontrar más información sobre este producto, sus efectos adversos y contraindicaciones.
FDA aprobó nueva formulación de ixekizumab (Taltz®), que reduce dolor por inyección.
Desde que, en 2016, se aprobó ixekizumab (Taltz®, Eli Lilly), más de 130 mil personas han sido tratadas con este producto en los Estados Unidos. Ahora se aprobó una nueva formulación libre de citrato en las inyecciones de 80 mg/ml. Esta nueva formulación incluye los mismos ingredientes activos que la original pero, al no incluir citrato, disminuye significativamente el dolor que experimentan algunos pacientes. Los estudios demostraron una disminución en el dolor inmediato luego de la inyección en un 86%. Este producto está aprobado para ser usado en adultos y niños mayores de 6 años con psoriasis en placa que sean candidatos para terapia sistémica, y en adultos con artritis psoriásica activa, con espondilitis anquilosante o con espondiloartritis axial no radiográfica con signos objetivos de inflamación. Los pacientes en tratamiento no necesariamente requerirán una nueva receta o indicación médica. Esta nueva formulación también ha sido aprobada por la Agencia Europea de Medicamentos. En www.taltz.com se puede encontrar más información sobre sus indicaciones, contraindicaciones y efectos adversos.
FDA aprobó dupilumab (Dupixent®) como primer tratamiento para adultos y niños de 12 años o más con esofagitis eosinofílica.
La FDA otorgó aprobación a dipilumab (Dupixent®; Sanofi, Regeneron) para tratar la esofagitis eosinofílica (EoE) en pacientes de 12 años o más y que pesen al menos 40 kg. Este es el primer y único medicamento aprobado en los Estados Unidos para esta condición. Este producto, en su presentación de 300 mg por semana, mejoró significativamente los signos y síntomas de la EoE en comparación con placebo en un ensayo Fase III. La EoE es una enfermedad inflamatoria crónica y progresiva provocada por una inflamación de tipo 2 que daña el esófago y evita que funcione correctamente. En los Estados Unidos hay unos 160 mil pacientes con EoE; reciben tratamiento con terapias no aprobadas específicamente para la enfermedad y, de ellos, cerca de 50 mil continúan experimentando síntomas a pesar de múltiples tratamientos. Esta aprobación es la primera indicación de este producto para una enfermedad gastrointestinal, y la cuarta enfermedad indicada en general. En el sitio web www.dupixent.com se puede encontrar más información sobre su uso, efectos adversos y secundarios.
FDA aprueba risankizumab-rzaa (Skirizi® ) para tratar la enfermedad de Crohn activa de moderada a severa en adultos.
La FDA aprobó a risankizumab-rzaa (Skirizi®, AbbVie) como el primer y único inhibidor de interleucina-23 (IL-23) específico para tratar a adultos con enfermedad de Crohn (EC) activa de moderada a severa. En dos estudios clínicos de inducción y uno de mantenimiento, este producto demostró mejoras significativas en la respuesta endoscópica inicial o en pacientes con enfermedad ileal aislada, y en la remisión clínica en comparación con placebo, tanto en terapia de inducción como de mantenimiento. Para el tratamiento de EC, el régimen de dosificación es de 600 mg en infusión i.v. en al menos una hora en la semana 0, la semana 4 y la semana 8, seguido de 360 mg administrados por el mismo paciente en inyección s.c. con un inyector corporal (IC) en la semana 12, y cada 8 semanas de ahí en adelante. La opción de dosis s.c. de mantenimiento de 180 mg administrada por el paciente se encuentra en revisión por la FDA. La EC es crónica, sistémica y progresiva; la mayor parte de los pacientes presentan síntomas impredecibles que afectan de manera significativa sus vidas diarias. En www.skirizi.com hay más información y detalles sobre este producto, sus contraindicaciones y efectos adversos.
Se llevó a cabo la 32ª Reunión Anual de PIA.
La Asociación de la Industria Farmacéutica de Puerto Rico (PIA) celebró su 32ª Reunión Anual en el Hotel Caribe Hilton con la participación de diversos conferenciantes locales e internacionales y cientos de profesionales de la industria farmacéutica, encabezados por Ileana Quiñones, Presidenta de PIA.
Destacan el impacto económico de la industria biofarmacéutica en Puerto Rico.
La Asociación de la Industria Farmacéutica de Puerto Rico (PIA) destacó el impacto económico de la industria biofarmacéutica en la isla con una aportación de más de $3,000 millones en contribuciones al fisco, lo que representa cerca del 37% de los ingresos que recauda el Gobierno local. El economista Leslie Adames – Director de la División de Análisis y Política Económica de Estudios Técnicos, Inc.– indicó que la industria biofarmacéutica aporta el 18% del PBI y genera más de 87 mil empleos directos e indirectos en la isla. Esto incluye 18 mil empleos directos en diferentes compañías farmacéuticas que operan localmente y cuyos empleados aportan más de $150 millones en contribuciones anuales. Se estima que se paga una nómina de más de $1,400 millones anuales. La industria adquiere productos y servicios locales que se valoran en más de $750 millones al año. Puerto Rico produce 4 de los 20 medicamentos de mayor consumo en el mundo. En total, 11 de las 20 compañías principales biofarmacéuticas del mundo tienen operaciones en Puerto Rico, generando empleos, actividad económica, pagando patentes e invirtiendo en programas comunitarios y educativos. Su inversión en infraestructura en la isla supera los $10,000 millones y hay una inversión anual de $500 millones en mantenimiento de esta infraestructura. Puerto Rico cumple con los más altos estándares de calidad de clase mundial, con tecnología de avanzada y distribuye medicamentos a más de 100 países alrededor del mundo. Para más información puede acceder www.piapr.org
Bristol-Myers Squibb apoya iniciativa contra el cáncer.
Por 12 años consecutivos, Bristol-Myers Squibb (BMS) se unió a la iniciativa “Da Vida Caminando con Raymond” en colaboración con la Liga Puertorriqueña Contra el Cáncer y en solidaridad con los pacientes del Hospital Oncológico. Los empleados de BMS se unieron con Raymond Arrieta, en la ruta establecida de Humacao a Naguabo, para apoyar la lucha contra el cáncer. La caminata tiene el propósito de unir y crear conciencia sobre la ayuda que requieren los pacientes con cáncer para sus tratamientos.
Médico residente de programa de Medicina Interna expone caso clínico en congreso internacional.
La Dra. Yolanda Hidalgo –residente de Medicina Interna del Centro Médico Episcopal San Lucas en Ponce– presentó el caso de una extraña enfermedad pulmonar en el congreso internacional CHEST Congress 2022, celebrado en Bologna, Italia. Lo hizo acompañada por la Dra. María Valentín, Directora de Educación Médica Graduada San Lucas. El caso presentado se relaciona con microlitiasis alveolar pulmonar (o PAM), una extraña enfermedad pulmonar genética. Al momento, no existen casos reportados o publicados de esta condición en la región del Caribe.
Egresado de UPR en Mayagüez y de la Escuela de Medicina San Juan Bautista recibe reconocimiento en oftalmología.
El Dr. Emile R. Vieta Ferrer –egresado de la UPR en Mayagüez, de la Escuela de Medicina San Juan Bautista y con una research fellowship en Genética Oftálmica en el Instituto Nacional del Ojo de NIH– fue el primer recipiente del premio “Next Generation” en genética oftálmica de la Academia Americana de Genética Médica (ACMG) en la convención realizada en Nashville, TN, premio que incluye una beca para investigación. Es el primer médico en formar parte de un programa de residencia combinada. El programa EyeSTAR Genetics es parte del Instituto del Ojo Jules Stein de UCLA, California. El Dr. Vieta Ferrer espera culminar también un entrenamiento en Oftalmología Pediátrica para regresar a Puerto Rico a desarrollarse en el campo asistencial médico y como investigador.