El ratón como base de modelos de cáncer humano: Una valiosa herramienta en la investigación oncológica
En Puerto Rico, en el 2008, el cáncer fue la segunda causa de muerte, después de las enfermedades del corazón. Además, según datos de 1999-2003, una de cada tres personas en el país será diagnosticada con cáncer durante su vida. Estas cifras alarmantes son un estímulo para continuar la investigación científica de esta terrible enfermedad. Un componente importante de la investigación de cáncer es el ratón. El propósito de este artículo es presentar la valiosa contribución de los modelos de cáncer humano basados en ratones en la investigación oncológica y su relevancia para hallar la prevención y la cura de esta enfermedad.

Wilfredo E. De Jesús-Monge, MD, MSc
Asociado postdoctoral de investigación
Miembro del Grupo de Trabajo de Páncreas
Escuela de Medicina de la Universidad de Massachusetts, Worcester, MA
wilmedresearch@yahoo.com
Introducción
El ratón es reconocido como el sistema mamífero experimental ideal. Sus atributos han facilitado el desarrollo de modelos que replican el cáncer humano. El modelo de cáncer humano basado en ratón ha sido significativo en el estudio de los mecanismos moleculares del cáncer, y así, en algún grado, en el desarrollo de nuevos agentes antitumorales. Por ejemplo, el mesilato de imatinib, utilizado para tratar la leucemia mieloide crónica, eliminó células positivas para BCR-ABL inyectadas en ratones desnudos (sin pelaje). También ratones que replican la leucemia promielocítica aguda respondieron a terapia de ácido retinoico all trans (ATRA). El uso del ratón para la investigación del cáncer tiene ventajas y desventajas (véase la Tabla 1). Sin embargo, comprendiendo las desventajas y tomándolas en cuenta durante la interpretación de los resultados de las investigaciones, el ratón sigue siendo una de las herramientas más valiosas para comprender mejor el desarrollo del cáncer. 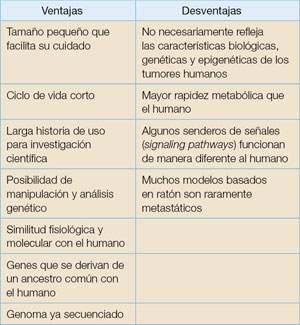
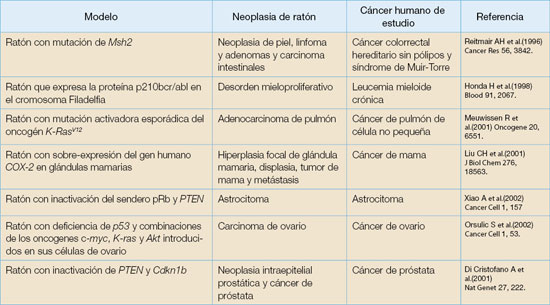
Estos modelos se basan en la susceptibilidad genética y en el mecanismo para la formación del tumor a estudiar (véase Tabla 2 en la página siguiente).
Ratón transgénico
El ratón transgénico se produce transfiriendo genes de otro organismo (transgenes) al ratón, en oocitos fertilizados, en células embrionarias tempranas o en células madres embrionarias en cultivo, y, luego insertando los transgenes en los cromosomas del ratón. Podría ser esencial, además, restringir la expresión del transgén al compartimiento celular donde el producto del mismo haría su efecto.
Manipulación de gen (gene targeting)
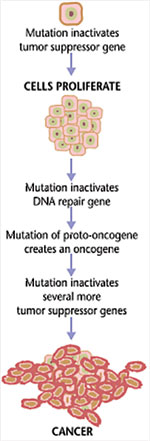
La manipulación de gen permite controlar condicionalmente e in vivo la ganancia o pérdida de función de un gen específico en ratones inmunocompetentes. Para imitar la ganancia de función genética, un oncogén (gen que induce cáncer) es insertado en el genoma del ratón como un transgén. Raf es un ejemplo de oncogén y su alteración en la versión humana se asocia al carcinoma de vejiga urinaria. Para imitar la pérdida de función genética, un gen supresor de tumor es inactivado. Apc es un ejemplo de gen supresor de tumor y su inactivación se asocia a los carcinomas de colon y recto, páncreas, estómago y próstata. Más aún, se han generado modelos para el estudio de la cooperación entre varios genes relacionados con el cáncer. Por ejemplo, simultáneas mutaciones en el oncogén K-ras y el gen supresor de tumor Tp53 cooperan para producir adenocarcinoma de ducto pancreático metastático. La ventaja de esta tecnología es que el evento genético que inicia la tumorigénesis es conocido y la progresión del tumor se puede estudiar con la subsiguiente y sistemática manipulación genética. Por consiguiente, este modelo de cáncer humano basado en ratón es útil para la evaluación de intervenciones terapéuticas preventivas o tempranas.
Xenoinjerto
El xenoinjerto permite el estudio in vivo de tejido y células de tumor humano implantados en ratones inmunocomprometidos, por lo que la posibilidad de rechazo del tejido o células humanas es limitada. Asimismo, una desventaja de este modelo es que no se puede estudiar el rol del sistema inmunológico en la progresión del tumor. Otra limitación del xenoinjerto es que el tumor ya está formado y, por lo tanto, no se puede estudiar el inicio de la tumorigénesis.
Transplante singénico
El transplante singénico consiste en el transplante de tumor en ratones con el mismo trasfondo genético del ratón del cual se aisló el tumor. La ventaja es que el tumor transplantado y el estroma (armazón de células conjuntivas) que le rodea son de la misma especie. Sin embargo, esto presenta dos limitaciones: una carencia de la complejidad genética de los tumores humanos y una tasa de metástasis usualmente baja.
Ensayos de metástasis
Los ensayos de metástasis consisten en la colocación de células tumorales en la circulación sistémica del ratón y en el análisis de su capacidad para colonizar órganos distantes. Su limitación es que solo estudia la etapa tumoral de colonización metastática, ignorando así el análisis de las etapas previas. Esto se facilita mediante inyección de las células en vías específicas, dependiendo del órgano metastatizado de interés:
1. La vena lateral de la cola, para colonizar el pulmón; 2. Las venas intraesplénica o portal, para colonizar el hígado; 3. La planta de la pata, para espontáneamente invadir y entrar al torrente sanguíneo; y 4. El corazón, para colonizar todas las regiones del cuerpo.
Carcinogénesis química
La carcinogénesis química consiste en exponer al ratón a agentes químicos que simulan la influencia de factores ambientales y provocan alteraciones genéticas, conducentes a lesiones precancerosas, y consecuentemente al cáncer de estudio. Este modelo es valioso para estudios de prevención química y sus ventajas son la naturaleza heterogénea y la diversidad de las lesiones tumorales producidas. Varios ejemplos son: nitrosamina N-butil-N-(4-hidroxibutílica) oral, para producir cáncer de vejiga urinaria; 4-(metilnitrosamino)-1-(3-piridil)-1-butanona intraperitoneal, para producir cáncer de pulmón; y óxido de 4-nitroquinolina-1 oral, para producir cáncer de esófago, lengua y mucosa oral.
Conclusión
Los modelos de cáncer humano basados en el ratón han sido de alto impacto para el estudio del origen, desarrollo y comportamiento clínico del cáncer. A su vez, han sido herramientas preclínicas importantes para probar nuevas estrategias preventivas y terapéuticas y para estudiar la sensitividad y resistencia a nuevos medicamentos, por parte del cáncer. La utilización de los modelos de cáncer humano basados en el ratón podría llevar finalmente a hallar la manera efectiva de prevenir y curar el cáncer.
- Asociado postdoctoral de investigaciónMiembro del Grupo de Trabajo de PáncreasEscuela de Medicina de la Universidad de Massachusetts, Worcester, MAwilmedresearch@yahoo.com