SUPLEMENTO SPED
Enfermedad ocular tiroidea:
Nuevos avances en su manejo

Michelle Mangual, MD
Endocrinóloga
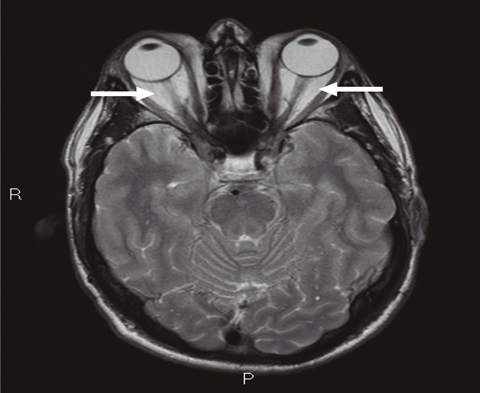
La enfermedad ocular tiroidea (TED, por sus siglas en inglés) es una afección autoinmune relacionada con la enfermedad de Graves. Se caracteriza por edema intersticial endomisial, expansión y proliferación de células dentro del compartimento fibroadiposo, manifestaciones clínicas de edema periorbitario, retracción palpebral, proptosis, diplopía, daño a la córnea y –en casos raros– compresión del nervio óptico. Es un desafío para los médicos en cuanto a su evaluación y tratamiento. Recientemente han surgido nuevas terapias que aún se están estudiando.
La mayoría de los pacientes con TED desarrollan enfermedades oculares mientras son tratados para hipertiroidismo por endocrinólogos o médicos primarios. Estos juegan un papel fundamental en el diagnóstico, manejo y selección de pacientes que requieren atención especializada. Para orientar a los médicos, la American Thyroid Association (ATA) y la European Thyroid Association (ETA) han producido recomendaciones conjuntas para TED.
Epidemiología
Hay una estrecha relación temporal entre el inicio del hipertiroidismo por enfermedad de Graves (EG) y TED cuando ocurren ambos trastornos. En el 80% de estos casos, el hipertiroidismo y TED se desarrollan dentro de los primeros 2 años. Es raro que TED ocurra en pacientes eutiroideos o con tiroiditis autoinmune crónica; casi siempre se asocia a anticuerpos estimulantes del receptor de la tirotropina (TRAb). La prevalencia de TED entre pacientes con EG es hasta 40%. TED de moderada a severa y la que amenaza la vista ocurre en el 6% y en el 0.5% de pacientes con EG, respectivamente.
Patogénesis
TED se desarrolla a partir de la inflamación mediada por autoinmunidad del tejido conectivo dentro y alrededor de los músculos extraoculares, la grasa intraorbitaria y, menos frecuentemente, afecta las glándulas lagrimales de algunos pacientes con EG. La relación entre TED y TRAb apoya la hipótesis de que el receptor de TSH (TSHR) es el autoantígeno primario. El receptor del factor de crecimiento similar a la insulina-1 (IGF-1R) también parece estar involucrado en la inflamación orbital, la adipogénesis y la remodelación tisular. La fase activa de la enfermedad se caracteriza por la infiltración de linfocitos en los tejidos orbitales y la acumulación de glucosaminoglucanos hidrofílicos, edema intersticial y aumento en la adipogénesis. La fase inactiva de la enfermedad consiste en el aumento en fibrosis y la infiltración grasa de los tejidos afectados.
Factores de riesgo y prevención
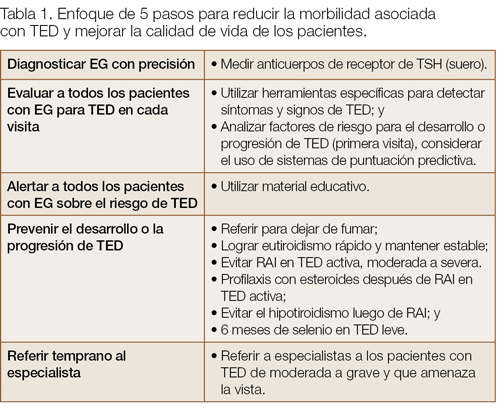
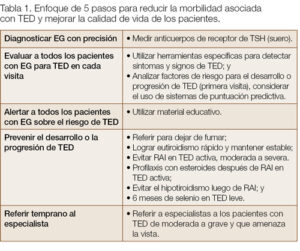
Factores de riesgo no modificables para el desarrollo y la severidad de TED son edad avanzada, sexo masculino y factores genéticos. Los modificables son fumar cigarrillos, la disfunción tiroidea y el uso de yodo radiactivo (RAI). Factores adicionales modificables son el estrés oxidativo y los niveles séricos elevados de TRAb, que se afecta por la elección de terapia para el hipertiroidismo. La terapia con estatinas se asocia a un menor riesgo de desarrollar TED en EG. Los esteroides como profilaxis en RAI, la normalización de los niveles de hormonas tiroideas y el uso de selenio en enfermedad activa leve pueden alterar la historia natural de TED (Tabla 1).
Evaluación del paciente
Un objetivo en TED es evaluar factores que nos ayuden a predecir los resultados. Se distingue en TED entre los dos componentes interdependientes de la actividad inflamatoria, manifestada por dolor, edema y enrojecimiento, y la gravedad de la enfermedad, incluida la proptosis, la mala posición del párpado, la queratopatía por exposición, la afectación en la motilidad ocular y la neuropatía óptica. La presencia de varias características de inflamación suele significar que hay enfermedad activa; esto se apoya aún más en un historial de TED progresivo. En la Tabla 2 se dan las definiciones de actividad y gravedad.
Hay una pequeña proporción de pacientes con TED que progresan a enfermedad severa que amenaza la vista y que se pueden identificar a partir del historial y del examen físico. Estos pacientes con TED de «alto riesgo» tienen los factores de riesgo presentados en la Tabla 3 y ameritan un seguimiento cercano.
Enfoque general de la terapia
Se debe ofrecer a los pacientes con TED medidas locales y la intervención en el estilo de vida. Se pueden usar lubricantes y máscaras oculares nocturnas para prevenir o tratar la exposición corneal. Se puede ofrecer oclusión ocular y prismas para aliviar la diplopía. Debe explicarse la importancia de dejar de fumar y ofrecer apoyo a los fumadores para lograr esto. Se recomienda el aporte de endocrinólogos y oftalmólogos con experiencia en TED para un manejo óptimo en pacientes con TED de moderada a grave y en aquel que amenaza la vista. Se debe consultar a un oftalmólogo cuando el diagnóstico de TED es incierto, en casos de TED de moderado a grave y cuando se debe considerar una cirugía. Esto es urgente cuando se sospecha o se confirma un TED que amenaza la vista.
Tratamiento para TED leve
El selenio se ha recomendado para pacientes con TED leve. Su uso se basa en su incorporación en proteínas que contienen selenocisteína, que pueden tener efectos antioxidantes e inmunomoduladores sobre la inflamación orbital. En un ensayo europeo multicéntrico controlado que incluyó la ingesta de selenio en la dieta, los pacientes fueron asignados al azar para recibir 100 mcg/bid de selenito de selenio, o placebo por 6 meses. Después de 6 meses, se observaron mejoras en las puntuaciones CAS y GO-QOL con la terapia con selenio, pero no con el placebo, que persistieron por 6 meses después de suspender la terapia. Si esta terapia es eficaz en otros lugares, sigue siendo una pregunta importante. La cantidad diaria recomendada de selenio en los Estados Unidos es de 55 mcg diarios, que es mucho menor que la dosis utilizada en TED leve. Los beneficios de la suplementación con selenio deben sopesarse con posibles efectos adversos (posible aumento del riesgo de cáncer de próstata y cáncer de células escamosas, y diabetes tipo 2, que es controversial). La evidencia actual no respalda extender la duración del tratamiento sobre los 6 meses. Por lo tanto, se puede considerar un curso único de selenito de selenio 100 mcg/bid por 6 meses para pacientes con TED activa leve, particularmente en regiones con insuficiencia de selenio.
Tratamiento para TED moderada a severa
Glucocorticoides (GC): estos alteran la distribución, la supervivencia y el tráfico de leucocitos, interfieren con la función de las células B y T y reducen el reclutamiento de monocitos y macrófagos. La terapia con GC i.v. (IVGC) es el tratamiento preferido para la TED activa de moderada a grave, en ausencia de proptosis o diplopía significativas. La dosificación estándar con IVGC consiste en metilprednisolona i.v. (IVMP) en dosis acumulativas de 4.5 g por unos 3 meses (0.5 g semanales x 6 semanas, seguidas de 0.25 g semanales por 6 semanas adicionales). Si la respuesta es deficiente a las 6 semanas, se debe considerar suspender el tratamiento y evaluar otras terapias. Debemos estar alerta ante el empeoramiento de la diplopía o la aparición de neuropatía del nervio óptico durante el tratamiento con IVMP. Se debe evitar una dosis acumulada de IVMP sobre los 8 g.
Rituximab y tocilizumab pueden considerarse para la inactivación de TED en pacientes resistentes a GC con TED activa de moderada a grave. Teprotumumab no ha sido evaluado en este entorno.
Teprotumumab (TEP): en la última década surgieron más pruebas sobre el papel en la interacción del TSHR y el IGF-1R en la fisiopatología de TED. TEP es el agente más nuevo para el tratamiento de TED y, paradójicamente, es el único fármaco aprobado por la FDA para tratar TED en pacientes sobre los 18 años, aunque metilprednisolona ha sido aprobada por la FDA durante mucho tiempo para el “tratamiento ocular de condiciones inflamatorias que no responden a los corticosteroides tópicos”. Hay más datos de ensayos controlados disponibles para TEP que para cualquier otro agente en uso actual, y parece ser la terapia más completa y efectiva hasta la fecha. De acuerdo a los resultados clínicos, TEP es la terapia preferida, si está disponible, en pacientes con TED activa de moderada a grave con proptosis significativa y/o diplopía.
Rituximab (RTX): RTX se dirige al CD 20 en las células B activadas y afecta la producción de nuevos anticuerpos y la función auxiliar mediada por células B. RTX se ha utilizado para TED durante los últimos 15 años. Se ha reportado que cerca de 160 pacientes recibieron RTX para TED y hay 2 estudios pequeños aleatorizados de un solo centro con un total de 28 pacientes tratados con RTX. La evidencia de los estudios es limitada y divergente, pero sugiere la eficacia de RTX para la inactivación de TED y la prevención de recaídas por más de 1 año, en particular en casos de TED de más de 9 meses de duración. La terapia con RTX es aceptable en pacientes con TED activa de moderada a grave y compromiso prominente de los tejidos blandos.
Micofenolato: ejerce efectos inmunomoduladores al inhibir la síntesis de monofosfato de guanosina, inhibe la proliferación de células T y B, suprime la producción de anticuerpos e interfiere con la quimiotaxis. La experiencia publicada en TED se limita a 2 estudios aleatorizados controlados, un ensayo no aleatorizado y un estudio retrospectivo. Los estudios han revelado resultados conflictivos, mostrando beneficio en uno y efecto neutral en otro. La terapia combinada de metilprednisolona i.v. con micofenolato se recomendó recién como terapia de primera línea para TED en las guías europeas, pero en las publicaciones recientes se consideró que los datos limitados y los hallazgos inconsistentes hasta la fecha no son lo suficientemente convincentes.
Tocilizumab (TCZ): la interleucina-6 se expresa en los fibroblastos orbitarios de pacientes con TED y parece promover la inflamación. TCZ es un bloqueador del receptor de interleucina-6. TCZ se ha utilizado ampliamente para la artritis inflamatoria. Los informes sobre su uso en TED se limitan a menos de 100 pacientes, en su mayoría de un solo centro. TCZ es un tratamiento aceptable para la inactivación de TED en pacientes resistentes a GC con enfermedad activa de moderada a grave.
Radioterapia (RT): la RT se ha utilizado para tratar TED durante más de 70 años y puede funcionar al inhibir o agotar los linfocitos y fibrocitos en el tejido orbital afectado. Su eficacia es variable en los estudios clínicos, y la interpretación se ve obstaculizada por criterios de inclusión y análisis de resultados divergentes. La RT es un tratamiento preferido en TED activa de moderada a grave cuya característica principal es la diplopía progresiva. La RT debe usarse con precaución en pacientes con diabetes para evitar una posible retinopatía. Está relativamente contraindicada para personas menores de 35 años con el fin de evitar el riesgo teórico de desarrollar tumores en el campo de radiación.
Intervención quirúrgica para TED de moderada a severa, inactiva
La cirugía electiva para corregir la proptosis, el estrabismo, la mala posición de los párpados y las bolsas de grasa se puede iniciar en TED inactiva cuando se haya mantenido la estabilidad clínica y se haya logrado un estado eutiroideo antes de la cirugía. La motilidad ocular generalmente debe ser estable por 4 a 6 meses antes de una cirugía de estrabismo. La rehabilitación quirúrgica para TED es un enfoque por etapas, que aborda primero la proptosis, luego el estrabismo y, por último, los cambios en los párpados. No todos los pacientes requieren todos los procedimientos. Las mejoras en la calidad de vida a menudo ocurren como resultado de la rehabilitación quirúrgica para TED.
Tratamiento de TED cuando amenaza la vista
La neuropatía óptica puede deberse a la compresión del nervio óptico por un músculo extraocular agrandado en el vértice de la órbita o, en menos del 5%, por el estiramiento del nervio por una proptosis. Es importante distinguir radiográficamente estas dos formas, ya que el estiramiento del nervio óptico no responde a tratamientos médicos y requiere descompresión quirúrgica para reducir la proptosis. Durante muchos años, la descompresión orbitaria ha sido el tratamiento estándar para la neuropatía óptica, pero los IVGC también han demostrado ser efectivos y actualmente se utilizan de primera línea, para tratar de evitar la cirugía. Aunque no se ha establecido la dosis ni la pauta óptima de GC, el uso recomendado de dosis altas (0.5-1.0 g/d) de IVMP por 3 días consecutivos o alternos se basa en la experiencia del tratamiento de pacientes con neuritis óptica de otras etiologías. La literatura define la respuesta a IVGC de manera bastante amplia como «recuperación visual», pero no proporciona datos cuantitativos sobre las mejoras en los campos visuales y la visión del color. Se ha informado que IVGC es eficaz en alrededor del 40% de los pacientes con neuropatía óptica, generando mejoras en la agudeza visual y evitando la descompresión orbitaria posterior. Por lo tanto, IVGC debe considerarse como el tratamiento preferido con el fin de evitar o posponer la cirugía. La presencia de inflamación o atrofia del disco óptico en el momento del diagnóstico es predictiva de una respuesta inadecuada a IVGC, pero no debe ser razón para no intentar esta estrategia y evaluar la eficacia en un paciente en particular. El deterioro visual a las 2 semanas de iniciar el tratamiento también es predictivo de una mala respuesta a IVGC. Aunque la descompresión quirúrgica tardía aún puede brindar beneficios para la neuropatía óptica, es posible que no permita la restauración completa de la función visual normal.
Conclusión
Las opciones de tratamiento durante la fase activa (fármacos inmunomoduladores) y la fase inactiva (procedimientos quirúrgicos correctivos) deben discutirse cuidadosamente con los pacientes. Las diferencias en los sistemas de atención médica regionales, e incluso locales, afectan la disponibilidad de las terapias actuales, y estos factores son críticos en la individualización de la atención.
Referencias
- Burch HB, Perros P, Bednarczuk T, et al. Management of Thyroid Eye Disease: A Consensus Statement by the American Thyroid Association and the European Thyroid Association. Thyroid. 2022; 32 (12): 1439-1465.