Hiperaldosteronismo primario:
Una causa de hipertensión más común de lo que se pensaba

José M García Mateo, MD, FACE
Endocrinólogo y Lipidólogo Clínico
Introducción
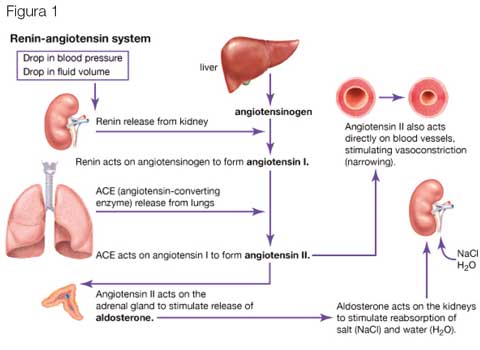
El hiperaldosteronismo primario (HAP) se caracteriza por un aumento en la secreción de aldosterona independiente del sistema renina-angiotensina y que, por lo general, cursa con hipertensión arterial y –en algunos casos– con hipopotasemia. La hormona aldosterona se segrega en la zona glomerular de la corteza suprarrenal, bajo el control de 3 factores principales: la angiotensina II, el potasio y, en menor medida, la hormona corticotropa (ACTH). La aldosterona es el producto final del sistema renina-angiotensina-aldosterona. Este sistema se pone en marcha con la síntesis de la enzima renina (secretada por células del aparato yuxtaglomerular en respuesta a la depleción del sodio y la hipovolemia) y se inhibe por la expansión intravascular. La renina activa en el hígado al angiotensinógeno y lo convierte en angio-tensina I, que se puede transformar en angiotensina II por acción de la enzima convertidora de la angiotensina (ACE). La angiotensina II tiene una acción vasoconstrictora, estimula la fibrogénesis a nivel vascular y cardiaco, y es uno de los principales factores estimulantes de la secreción de aldosterona.
El factor limitante del sistema renina-angiotensina es la secreción de renina en respuesta a 4 factores:
- La mácula densa que monitoriza la carga de sodio y cloruro en el túbulo distal;
- Las células yuxtaglomerulares que detectan la presión de perfusión renal;
- El sistema nervioso simpático, que modifica la liberación de renina en posición erecta; y
- Algunos factores humorales como el potasio, la angiotensina II (estimulan la secreción de aldosterona) y los péptidos natriuréticos atriales. (Fig. 1)
Etiología
La causa más frecuente del HAP es la hiperplasia bilateral de la zona glomerular suprarrenal o la hiperplasia suprarrenal bilateral idiopática (un 60% de los casos) seguida del adenoma productor de aldosterona o síndrome de Conn (30-40 %). Como causas excepcionales, se pueden citar la hiperplasia suprarrenal unilateral y el carcinoma adrenal o ectópico productor de aldosterona. El HAP familiar representa un pequeño porcentaje de casos y puede ser de 2 tipos: HAP familiar tipo I o remediable por los glucocorticoides que se asocia a un gen hibrido de la aldosterona sintetasa (CYP11B2) y HAP familiar tipo II, no ligado al CYP11B2 e insensible a los glucocorticoides. La prevalencia de HAP puede variar según la incidencia de hipertensión en el área evaluada y la presencia de hipertensión resistente.
Aspectos clínicos
Los síntomas clínicos del HAP –directos o indirectos– son inespecíficos y derivados de los efectos de la aldosterona. Los efectos directos de la aldosterona tienen las siguientes consecuencias:
- Supresión del eje renina-aldosterona con una disminución de la concentración de la renina;
- Hipertensión arterial. Suele aparecer entre la 3a y la 6a década de vida. Puede ser de moderada a grave y característicamente no presenta edemas; y
- Pérdida de potasio e hidrogeniones que llevan a hipopotasemia, alcalosis metabólica, debilidad y calambres musculares, poliuria y nicturia.
Los efectos indirectos de la aldosterona se relacionan con cambios que producen una angiopatía con disfunción endotelial y fibrosis de tejidos (sobre todo en corazón, vasos y riñones), en un proceso independiente sobre la tensión arterial. Estos efectos son responsables de peculiaridades de la hipertensión arterial en estos pacientes (presentan una mayor prevalencia de retinopatía hipertensiva, una mayor hipertrofia del ventrículo izquierdo y una mayor incidencia de eventos cardiovasculares que otros sujetos hipertensos). Si el diagnóstico se sospecha tempranamente, el paciente puede estar asintomático, pero puede sufrir los efectos adversos directos e indirectos de la hipersecreción de aldosterona.
Abordaje diagnóstico
Es importante establecer un diagnóstico correcto del HAP por las implicaciones terapéuticas que conlleva (tratamiento médico cuando hay hiperplasia bilateral idiopática o quirúrgico si hay adenoma suprarrenal).
El abordaje diagnóstico del HAP se debe de establecer de forma secuencial mediante:
- Pruebas de cernimiento;
- Pruebas de confirmación; y
- Pruebas de localización.
Pruebas de cernimiento (cribado o tamizaje)
Estas se indican en pacientes con elevada sospecha de HAP, por presentar características como:
- Hipertensión arterial severa (> 150/100 mmHg);
- Hipertensión arterial resistente a fármacos: sobre 140/90 mmHg a pesar de usar 3 antihipertensivos o más de 4 fármacos para lograr su control;
- Pacientes hipertensos con una hipopotasemia espontánea o inducida por diuréticos;
- Hipertensión con un incidentaloma suprarrenal;
- Hipertensión en pacientes con apnea del sueño;
- Hipertensión e historia familiar de HAP en jóvenes o de accidente cerebrovascular antes de los 40 años; e
- Hipertensión en familiares de primer grado de un paciente diagnosticado con HAP.
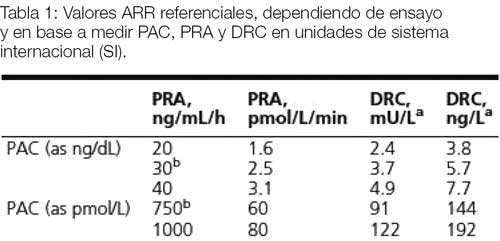
Los métodos actuales indican una prevalencia del 15 al 20% de las hipertensiones arteriales, observándose hipopotasemia en menos del 50% de los casos. Si bien no hay unanimidad de criterios y hay falta de estandarización, la relación entre la aldosterona (en ng/dL) y la actividad de renina plasmática (en ng/mL/h) se considera la prueba de elección para el despistaje del HAP. Los límites de detección que miden la actividad de la renina plasmática o su concentración (renina directa) tienen una repercusión muy importante en esta relación. El valor aldosterona/renina, al ser un cociente, puede estar influenciada por los valores bajos del denominador. Por eso, la actividad plasmática de renina disminuida (frecuente en ancianos o en insuficiencia renal) puede resultar en cifras falsamente elevadas. Para evitar esto se debe reconsiderar el diagnóstico de HAP cuando el nivel de actividad plasmática de renina no es mayor de 0,3ng/mL/h.
En general, se considera que una relación aldosterona/renina sobre 20 a 30 y una concentración de aldosterona no menor de 6 ng/dL es muy sugestiva de HAP. Si esto no se cumple pero hay la sospecha diagnóstica, se deben descartar interacciones con medicamentos utilizados por el paciente, en especial los que interfieren con el sistema renina-angiotensina aldosterona (antagonistas de minelarocorticoides como eplerenona y espirinolactona, los inhibidores del canal de sodio epitelial como amiloride y triamterene y los inhibidores de renina como aliskerin). Es raro que un inhibidor de convertasa de angiotensina o antagonista de receptor de angiotensina interfiera con estas pruebas diagnósticas, ya que en HAP la angiotensina ya está bastante suprimida. Si hay que retirar algún medicamento antihipertensivo para repetir la prueba se debe utilizar un fármaco con poca interacción a las mismas, como bloqueadores alfa o antagonistas de canales de calcio.
Al comparar los resultados, hay que tener en cuenta las unidades de medida de la aldosterona (ng/dL o pmol/L) y si se mide la actividad de renina plasmática (ng/mL/h) o su concentración (mU/L). Endocrine Society en sus guías de manejo de HAP publica una tabla que, aunque no muy estandarizada, presenta cifras para otras unidades de renina (Tabla 1).
Para lograr una estandarización correcta de la relación aldosterona/renina, se aconseja preparar al paciente para controlar todos los factores que influyen en la secreción de aldosterona o renina:
- Corregir la hipopotasemia antes de determinar las concentraciones de la renina y la aldosterona;
- Permitir una ingesta libre de sal;
- Hacer la prueba de relación aldosterona/renina sin descontinuar ningún fármaco que este utilizando el paciente para el control de su hipertensión;
- Cuando hay valores equívocos, se debe suspender 6 semanas antes del estudio el tratamiento con espironolactona, eplerenona, amiloride, triamterene y antagonistas de la renina. Si se debe mantener el tratamiento, se puede añadir fármacos antihipertensivos que interfieran poco con el eje renina aldostenona (verapamil, hidralazina, prazosín, tetrazosín o doxazosina); y
- Tener en cuenta las poco comunes interferencias de otros antihipertensivos (beta bloqueadores, diuréticos, inhibidores de enzima convertidora de angiotensina, Ca-antagonistas, etc.) en los resultados. Si son equívocos, suspender el tratamiento con estos fármacos otras 2 semanas antes de un nuevo análisis (rara vez es necesario).
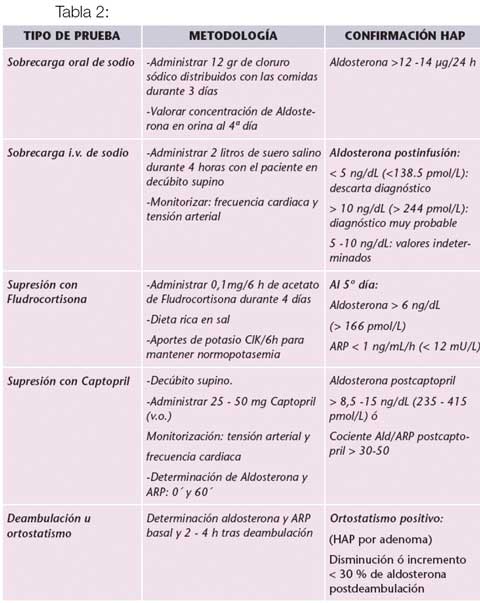
Pruebas de confirmación
No se necesitan más pruebas cuando el diagnóstico es claro con las pruebas previas y la aldosterona está sobre 20 mg/dL y hay hipopotasemia con renina bien suprimida (usualmente bajo 0.3 ng/mL/hr). Cuando el diagnóstico no está claro con la relación aldosterona/renina y con la clínica del paciente, se pueden usar pruebas de confirmación (ver tab. 2). La más utilizada es la carga oral de sodio. Como esto requiere aumentar el volumen intravascular en un paciente hipertenso, se debe supervisar al paciente para evitar complicaciones.
Pruebas de localización
Una vez confirmado el diagnóstico, se debe intentar determinar la localización con pruebas de imagen (CT o MRI) y diferenciar entre HAP por un adenoma suprarrenal o la hiperplasia suprarrenal bilateral idiopática. En muchos casos se requiere un muestreo selectivo de las venas suprarrenales para valorar la concentración de la aldosterona y determinar el origen uni o bilateral del HAP, antes de una cirugía. En el cateterismo de venas suprarrenales (con o sin estimulación con ACTH) se toma una muestra de sangre de la vena suprarrenal derecha y de la izquierda, y de una vena periférica como la vena cava inferior. Se calcula la relación aldosterona/cortisol de una glándula suprarrenal dividida entre la misma relación de la otra glándula y si es mayor de 3 (sin estímulo con ACTH, o mayor de 4 con infusión continua de ACTH), significa que hay una producción autónoma unilateral y que el paciente es candidato a una adrenalectomía. Estas cifras son arbitrarias y hoy se recomienda ver que el valor de lateralización sea alto y que el valor de la relación aldosterona/cortisol de la glándula no dominante sea menor que en la vena periférica. En el caso de que la relación sea menor de 3 y que el valor de la glándula no dominante sea mayor que en la vena periférica, la probabilidad de que la secreción de aldosterona sea bilateral aumenta; el manejo en ese caso sería médico, con espironolactona o eplerenona y, en algunos casos, combinación con amiloride.
Se debe confirmar si los catéteres se posicionaron bien midiendo la relación del cortisol de la vena suprarrenal y de la vena periférica. Si es mayor de 2 sin estímulo con ACTH –o de 5 con estímulo de ACTH–, se confirma que el cateterismo se realizó correctamente. Esto confirma o determina mejor la secreción uní o bilateral de aldosterona. La mayoría de autores opina que, en caso de hiperaldosteronismo confirmado en menores de 40 años y con una lesión hipodensa solitaria en una glándula suprarrenal, se podría realizar directamente el tratamiento quirúrgico sin requerir más pruebas. El muestreo de las venas suprarrenales es una prueba compleja cuyos resultados dependen de la pericia del radiólogo intervencionista y que implica la acción multidisciplinaria del radiólogo, del endocrinólogo, del cirujano y del especialista del laboratorio.
En cuanto a las pruebas radiológicas, debe considerarse que la imagen suprarrenal obtenida por tomografía solo logra clasificar correctamente la etiología del hiperaldosteronismo en el 50% de los casos y que en más del 60% de los pacientes no hay correlación entre dichas pruebas y los resultados del muestreo de las venas suprarrenales, debido a su baja sensibilidad y especificidad para esta entidad; de ahí la importancia de las pruebas bioquímicas para el diagnóstico de esta enfermedad. Hay estudios recientes que han refutado estos hallazgos y si no se dispone de la facilidad de hacer un muestreo suprarrenal, se podría utilizar el juicio clínico para la decisión quirúrgica o no quirúrgica.
Tratamiento
Cuando el tratamiento es quirúrgico por ser la hipersecreción unilateral, la cirugía la debe hacer un cirujano experto. La vía retroperitoneal es la de mayor preferencia, lo que requiere aún más entrenamiento y experiencia. Este tratamiento suele llevar a una cura y a descontinuar los fármacos para la hipertensión. Si el tratamiento es médico, se utilizan de primera línea antagonistas del receptor mineralocorticoide. El más usado es la espirinolactona, pero su efecto antiandrogénico puede causar en algunos hombres ginecomastia y/o disfunción eréctil. En estos casos se recomienda el uso de eplerenona que no tiene dichos efectos, pero que es más costoso y con menor poder antihipertensivo. El tratamiento médico se decide si la fuente de hiperaldosteronismo es bilateral, y el paciente prefiere proceder con el tratamiento médico y no desea más pruebas diagnósticas o cuando las condiciones médicas del paciente no favorecen una cirugía.
Aunque una gran cantidad de pacientes controlan su presión, normalizan su potasio y disminuyen el número de medicamentos, se ha demostrado que esto no es suficiente. Si la actividad de renina no se suprime con el tratamiento o no se baja a menos de 1ng/mL/h, los eventos cardiovasculares, la mortalidad y el riesgo de desarrollar complicaciones metabólicas como diabetes pueden seguir elevados. Sin embargo, tratar de suprimir este valor con mayor dosis de fármaco puede traer problemas de hipopotasemia, hipotensión y fallo renal por hipoperfusión renal. En estos casos hay que utilizar el juicio clínico y observar al paciente de cerca para prevenir complicaciones. Hay pocos casos –en centros especializados como la Clínica Mayo y Harvard– donde se ha tomado la drástica decisión de hacer una adrenalectomía unilateral no curativa para atenuar la hipersecreción ayudando así al tratamiento médico.
Conclusión
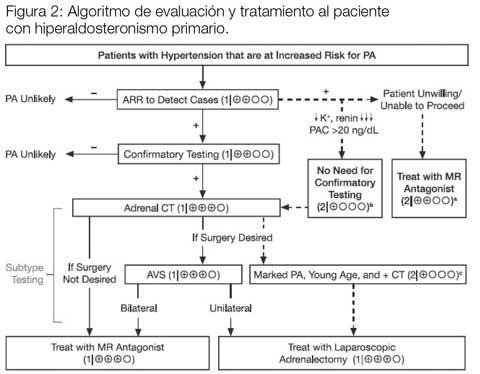
El HAP es más común de lo que se cree. Hay muchos casos de hipertensión, no siempre severa, donde se puede detectar tempranamente esta condición para así pasar a la evaluación y al tratamiento. El diagnóstico y tratamiento deben ser individualizados en cada caso (Fig. 2). Se deben considerar las pruebas diagnósticas, el juicio clínico, los recursos disponibles y la decisión del paciente para lograr resultados adecuados. Hay varias guías (Endocrine Society, American Association of Clinical Endocrinologists, etc.) que ayudan en su manejo. Con estas herramientas y con la evaluación multidisciplinaria de cada caso, tendremos éxito.
Referencias
- Funder JW, Carey RM, Mantero F et al. The Management of Primary Aldosteronism. J Clin Endocrinol Metab. 2016; 101:1889-1916.
- Vaidya A, Malchoff CD, Auchus RJ. An individualized approach primary aldosteronism. Endocr Pract. 2017; 23:680-689.