SUPLEMENTO ONCOLOGÍA - LEUCEMIA
Leucemia mieloide aguda:
Con más alternativas de tratamiento, pero considerando siempre su expectro de toxicidad

Justiniano Castro, MD
Hematólogo-Oncólogo
Sección de Hematología-Oncología
Hospital Universitario, Departamento de Medicina
Recinto de Ciencias Médicas de la Universidad de Puerto Rico
La leucemia mieloide aguda (AML) es una malignidad hematológica de presentacion aguda, usualmente de días a semanas de evolución, con una alta mortalidad a menos que se inicie el tratamiento adecuado lo antes posible. Se caracteriza por un aumento de células inmaduras en la sangre, a las que se denomina blastos. Estas células imaduras irán sustituyendo a los componentes normales de la médula ósea, afectando la producción de las distintas células normales de la sangre. Por tanto, las principales manifestaciones de la AML van a ser:
- Anemia;
- Sangrado (por plaquetas bajas, problemas de coagulación); y
- Fiebre (infecciones por la neutrpenia).
Uno de los subtipos de la AML con mejor pronóstico es la leucemia aguda promielocítica, pero esta necesita un manejo especializado ya que la coagulación intravascular disenimada ocurre casi universalmente y tiene una alta mortalidad si no se identifica a tiempo.
Criterios diagnósticos
El diagnóstico de la AML requiere la evaluación de la sangre periférica y de la médula ósea. Los estudios a realizarse en estos casos incluyen:
- Morfologia de la sangre y de la médula ósea: idenficar blastos o células inmaduras y que superen el 20% de las celulas nucleadas en la médula;
- Tinciones citoquímicas: resaltan las caracteristas del linaje mieloide;
- Citometría de flujo: marcadores de superficie mieloides (CD33, CD13,CD14/15);
- Estudios de citogenética por cariotipo y fluorecencia: para detectar mutaciones que dictan el tratamiento; y
- Estudios moleculares para ciertos tipos de genes: sirven para el pronóstico y el tratamiento.
Clasificación y mutaciones
Una vez se diagnostica la AML, se debe determinar el subtipo específico de leucemia sobre la base de los criterios establecidos por la Organización Mundial de la Salud (OMS/WHO). La última revision de la clasificación de la AML se publicó en 2022. Los cambios incluyen la integración de las mutaciones de genes presentes con el subtipo específico de AML en particular y, además, se aceptaron ciertas mutaciones que son diagnósticas de la AML, sin necesitar el criterio de la presencia de más del 20% de células imaduras.
Evolución en el tratamiento
El tratamiento de las leucemias agudas ha tenido una importante evolución y hoy se utilizan agentes terapéuticos cuyo mecanismo de acción está basado en la presencia de ciertos genes mutados en las células leucémicas; esto se cononoce como un tratamiento dirigido. Aunque el éxito de los tratamientos ha aumentado en forma muy significativa, el uso del transplante alogénico de células progenitoras hematopoyéticas sigue jugando un rol fundamental en los casos de relapso de la leucemia aguda.
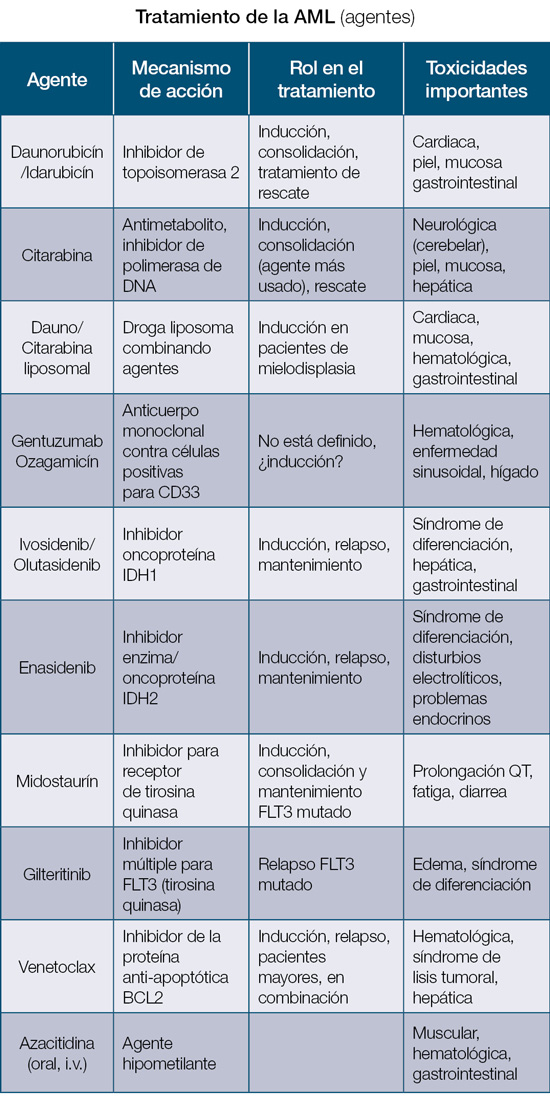
En Puerto Rico, la mayoría de los casos de AML se evalúan y tratan en el Hospital Universitario de Adultos. La Unidad de Leucemia en el cuarto piso del Hospital Universitario es única y cuenta con personal especializado para el manejo de estos casos. Esta unidad se estableció en la década de 1980 y juega un rol fundamental en el tratamiento de esta condición hasta el presente. Un estudio interesante presentado por este grupo incluyó 36 casos de leucemia promielocítica aguda que recibieron tratamiento con ácido transretinoico; el pronóstico de este grupo de pacientes fue muy bueno, con una sobrevida de casi el 75% (1995-1997), comparable con los mejores centros especializados en el tratamiento de esta condición. En la tabla se resumen los tratamientos disponibles para la AML y sus principales efectos adversos:
Complicaciones relacionadas con el tratamiento
Las complicaciones asociadas con el tratamiento de la AML son frecuentes y se requiere un grupo de profesionales de la salud experimentado para el manejo las mismas. La pronta identificación y el inicio del tratamiento ayuda a mitigar el daño asociado y la posibilidad de reversibilidad. Como regla general, la mayoría de los agentes quimioterapéuticos están asociados a toxicidad hematológica, daño a la mucosa, lesiones en piel, problemas gastrointestinales y toxicidad hepática. Por esto, se requieren un monitoreo rutinario del paciente y pruebas diarias de laboratorio. A continuación, discutiremos las complicaciones más serias y particulares asociadas a estos tratamientos.
Síndrome de lisis de tumoral
El síndrome de lisis tumoral ocurre por la destrucción de un alto número de células malignas y por la liberación al torrente sanguíneo de su contenido. Se caracteriza por desórdenes electrolíticos (hipocalcemia, hiperkalemia, hipofosfatemia), fallo renal, hiperuricemia y acidosis metabólica.
Se requiere hidratación intravenosa agresiva, alcalinizar la orina y medicamentos que reduzcan el ácido úrico. El alopurinol puede ayudar, pero su efecto terapéutico es sumamente lento. La rasburicasa es sumamente efectiva en disminuir la toxicidad y revertir el daño. Debe utilizarse de manera concomitante en casos de alto riesgo. Se puede administrar diariamente hasta por un máximo de 5 días. Ha sido asociada al desarrollo de metahemoglobinemia, que suele ocurrir durante el inicio de la terapia de inducción (terapia inicial).
El venetoclax es un agente usado frecuentemente en adultos mayores de 70 años en combinación con la azacitidina. Es un inhibidor potente de la proteína anti-apoptótica BCL2. Aunque este agente ha sido asociado con el síndrome de lisis de tumor, esto es extremadamente raro en la AML.
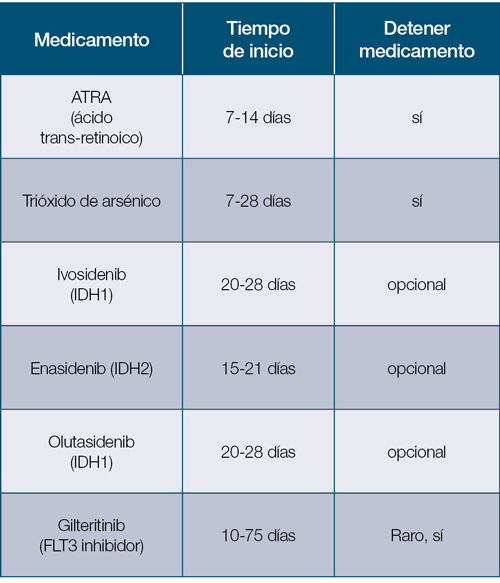
Síndrome de diferenciación
Esta complicación fue descrita inicialmente con el uso del ácido transretinoico para la leucemia promielocítica aguda (APL).
En el caso de la APL, los síntomas de este síndrome pueden empezar a observarse durante las primeras dos semanas del tratamiento. Se suele caracterizar por lo siguiente:
- Aumento en las células blancas;
- Fiebre;
- Dificultad respiratoria;
- Retención de líquidos;
- Hipotensión;
- Fallo renal;
- Problemas hepáticos;
- Efusión pleural y/o pericárdica; e
- Inclusive hasta la muerte.
El manejo incluye detener el medicamento, el uso de esteroides y un manejo de soporte. Usualmente es posible volver a utilizar el agente causante. El trióxido de arsénico también se ha utilizado en la APL; puede producir un cuadro de síndrome de diferenciación similar, aunque menos frecuente.
Los medicamentos que han sido asociados a esta complicación –síndrome de diferenciación– pueden incluir algunos de los siguientes:
Toxicidad cardiaca
La toxicidad cardiaca es una complicación seria de algunos agentes quimioterapéuticos y de algunos agentes de terapia dirigida que se usan hoy en día. Las antraciclinas tienen toxicidad directa al miocardio, que está relacionada con la dosis cumulativa del medicamento. Se recomienda un estudio basal del corazón, que debe repetirse durante el transcurso de los subsiguientes tratamientos.
Otros agentes que pueden producir toxicidad incluyen: Trióxido de arsénico, ácido transretinoico y gilteritinib, entre otros. Estos pacientes requieren monitoreo frecuente, telemetría y electrocardiogramas seriados. Es muy importante el seguimiento adecuado para la detección temprana de estos problemas.
Síndrome hepático de obstrucción sinusoidal (VOD)
Esta complicación es rara, pero puede ser bastante seria. Se presenta con un aumento dramático del peso del paciente, un aumento de la bilirrubina sérica, un leve aumento en las transaminasas y el fallo hepático como evento tardío. Se ha asociado a gemtuzumab ozagamicín, pero podría ocurrir con otros agentes. Se requiere manejo de soporte y se debe considerar el uso de defibrótida (ya que tiene efecto fibrinolítico que puede ayudar en el daño sinusoidal).
Toxicidad neurológica
La toxicidad neurológica es frecuente durante el tratamiento de la AML y, en algunos casos, puede ser irreversible.
La citarabina en particular es una droga que requiere una evaluación neurológica diaria, y debe considerarse la identificación de síntomas asociados a su toxicidad, en especial a nivel cerebelar. En la mayoría de los casos en que esto ocurra, se debe detener el medicamento. La gran mayoría de los fármacos que usamos para tratar la AML tienen cierto grado de toxicidad neurológica, pero esta es usualmente reversible y suele ser leve. La neuropatía periférica es también frecuente y puede producir mucha sintomatología de cuidado. Los exámenes seriados de sensibilidad son mandatorios.
Toxicidad en la piel y visual
Con mucha frecuencia, la piel puede ser afectada durante el tratamiento, siendo las erupciones eritematosas las afecciones más comunes.
La citarabina produce una erupción severa y usualmente reversible durante los primeros días de tratamiento. Otras manifestaciones en la piel incluyen: hiperpigmentación, eczema, xeroderma, descamación, alopecia y abrasiones. La severidad puede ser variable y es importante diferenciarla de la leucemia cutis que usualmente se relaciona con el fallo terapéutico. El cuidado diario de la piel con lubricantes, antifungales y, en algunos casos, esteroides debe incluirse en el manejo apropiado de estos pacientes.
La visión debe ser evaluada diariamente, ya que la toxicidad a las conjuntivas es común, siendo la queratoconjuntivitis la complicación más frecuente en estos casos. Se recomienda el uso de esteroides tópicos para la profilaxis de la toxicidad ocular de la citarabina.
Toxicidad hepática
La hepatitis química puede ser inducida por la mayoría de los agentes que se utilizan en los pacientes con AML. Las antraciclinas (daurorubicina e idarubicina) son agentes sumamente hepatotóxicos y se requiere un ajuste de dosis en pacientes con algún grado de problema hepático. La citarabina, aunque raras veces produce problemas hepáticos, podría tener de toxicidad y está asociada a un efecto autoinmune del medicamento.
Es necesario el monitoreo constante de la función hepática con pruebas de laboratorio y examen físico. La identificación temprana de esta toxicidad hace que aumente la posibilidad de su reversibilidad.
Comentario
Existe un sinnúmero de toxicidades que se han descrito con el tratamiento de la AML. Hemos discutido las más comunes, poniendo énfasis en la evaluación temprana con el fin de buscar la acción correctiva inmediata.
El manejo y el tratamiento de estos pacientes son complejos y requieren un trabajo en equipo con los distintos profesionales de la salud. Nosotros debemos familiarizarnos con estas posibles complicaciones, pues es posible que algunos de estos pacientes se presenten en alguna institución hospitalaria y necesiten nuestra ayuda.
Medicamentos como el eprenetapopt (inductor de apoptosis) y el megalimab (anticuerpo monoclonal contra el CD47) son algunos de los agentes prometedores que pronto podrían estar disponibles para usarse en estos casos, aumentando la esperanza de poder mejorar la sobrevida en los pacientes con leucemia mieloide aguda.
Referencias
- Wang ES, Baron J. Management of toxicities associated with target therapy in AML. ASH 2020.
- Talavera A, Castro J. AML in PR. (abstract). ASH 1997.
- WHO Classification. AML 2022. American College of Pathology.
- Williams Manual of Hematoly. 10th edition. 2022.
- Sallman DA, Al Malki MM, Asch AS, et al. Magrolimab combination with azacytidine for HR MDS. JCO. 2023 May 20, 4(15): 2815-2826.
- Mishra A, Tamari R, DeZern AE, Byrne MT, et al. Eprenetapopt and azacytidine after allogeneic transplant that relapse with AML P53 mutation. JCO. 2022, Dec, 1:40: 3985-3993.
- Dohner H, Wei W, et al. Diagnosis and management of AML in adults. Blood. 2022. 140(12): 1345-1377.
- KJ Norsworthy, et al. Clinical Cancer Research. FDA approval summary, Ivosidenib. 2019. 25(11): 3205-3209.
- De Botton S. Improved survival with Enasidenib vs. standard of care in relapsed/refractory AML associated with IDH2 mutation. Cancer Med. 2021, Sep. 10(18): 6336-6343.