Melanoma:
Importancia de factores de riesgo y opciones terapéuticas

Néstor Sánchez, MD, FAAD
Profesor de Dermatología y Patología
Escuela de Medicina, Universidad de Puerto Rico
Consultor, Hospital Menonita, Aibonito

Luis Enrique IV Santaliz-Ruiz, MD
Epidemiología
El melanoma es una neoplasia maligna de los melanocitos en el estrato basal de la epidermis, así como también de aquellos en el tracto uveal, el epitelio pigmentado de la retina, la mucosa gastrointestinal y las leptomeninges.1 Los melanomas cutáneos (MC) representan el 4% de todos los cánceres de la piel, pero ocasionan el 65% de las muertes relacionadas con carcinomas de la piel.2 Son más frecuentes en jóvenes y adultos de mediana edad. La edad promedio al momento del diagnóstico ronda los 57 años.3 En Puerto Rico, en el periodo 2010-2014, se reportaron 683 nuevos casos de melanoma y unas 96 muertes.4 En 2018, en los Estados Unidos se diagnosticaron con melanoma 91,270 personas, falleciendo 9,300 por esta enfermedad.4
Factores de riesgo para desarrollar MC
- Exposición a la luz solar. Es el factor de riesgo ambiental más importante, en especial la exposición al sol intensa e intermitente3,6 y la tendencia a quemarse al sol e incapacidad de tornarse bronceado;1
- Cámaras de bronceado. Su uso aumenta significativamente el riesgo de desarrollar MC (riesgo relativo 2.0);1,3,6
- Tez blanca. Pacientes con tez blanca (fototipo I-II), ojos azules, cabello naturalmente rojizo y/o pecas tienen un 50% más de riesgo para desarrollar MC. Sin embargo, pacientes con tez fototipo III-VI también pueden desarrollar MC;1,3
- Nevos melanocíticos. Los pacientes con más de 100 nevos melanocíticos tienen un riesgo relativo de 8-10 veces mayor que la población general para desarrollar MC;1,3
- Nevos melanocíticos congénitos de más de 20 cm (gigantes). Tienen entre un 5% y un 8% de riesgo de MC a lo largo de la vida;3,6
- Nevos displásicos o atípicos esporádicos. Tienen 10 veces más riesgo de desarrollar MC;6
- Historial personal de MC. Aumenta 10 veces el riesgo de MC;1,3,6
- Inmunosupresión. El compromiso inmunológico en pacientes recipientes de trasplantes de órganos eleva 2 veces el riesgo para sufrir MC;7
- Historial familiar de MC;1,3,6 y
- Genética:
a) Síndrome de nevos displásicos o atípicos (o síndrome de melanoma familiar con múltiples lunares atípicos, FAMMM). Es un desorden hereditario autosómico dominante con alta penetrancia, caracterizado por múltiples nevos atípicos (entre 50 y 100) en un individuo con historial familiar de 1 o más parientes de primer o segundo grado con historial de MC. Los pacientes con este síndrome tienen hasta un 90% de riesgo de padecer MC a lo largo de sus vidas, a una edad más temprana y hasta en lugares no expuestos al sol. También tienen riesgo de carcinoma pancreático. Se asocia a la mutación del gen CDKN2A o CDK4;1,3,6
b) Alteraciones genéticas en p16/CDK4,6/Rb, p14ARF/HMD2/p53, RAF-MEK-ERK y PI3K-Akt;6 y
c) Síndromes familiares como Li-Fraumeni, Lynch tipo II, retinoblastoma familiar, xeroderma pigmentoso, entre otros, tienen mayor riesgo de MC.1,3
Manifestaciones clínicas
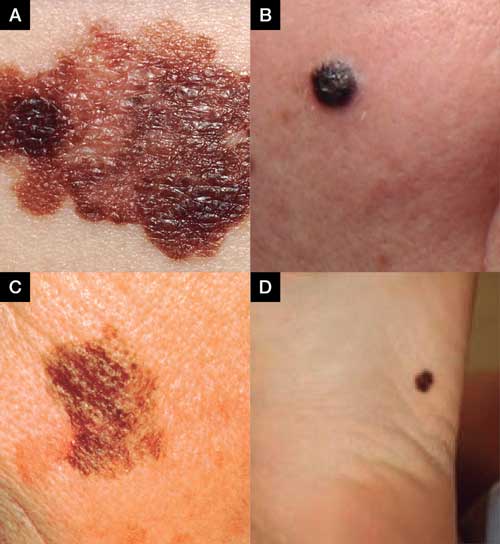
Muchos MC acaecen de novo, mientras otros surgen de lesiones preexistentes como los nevos melanocíticos.1 Por tal razón, es crucial examinar las lesiones pigmentadas que presenten ABCDE: Asimetría, Bordes irregulares, variación en Color (negro, marrón, rojo, azul, blanco), Diámetro sobre 6mm, Evolución (crecimiento horizontal o vertical), sangrado, ulceración o prurito.1,3,6
Principales 4 subtipos de MC
- Melanoma de extensión superficial (MES)
Es el más común (70%) y se presenta en cualquier parte del cuerpo, con predilección por la espalda en los hombres y las piernas en las mujeres. Tiene como una mácula o placa muy fina con coloración variada y bordes irregulares;1,3,6 - Melanoma nodular (MN)
Es el segundo más común (entre el 15% y 30%). Presenta como una pápula nodular o nódulo marrón oscuro, negro, azul oscuro y, otras veces, amelanocítico o de tonalidad rosa. Tiene peor pronóstico ya que desde su inicio el crecimiento es vertical e invasivo;1,3,6,8 - Melanoma léntigo maligno (MLM)
Constituye entre el 10 y el 15% de los MC. Se circunscribe a la epidermis, por lo que es un melanoma in situ. Suele surgir en áreas de exposición solar crónica como la cabeza y el cuello de envejecientes. Comienza como una mácula marrón y gradualmente crece, se torna más oscura con variación del color y bordes irregulares; 1,3,6,8 y - Melanoma acral (MA)
Comprende menos del 5% de los MC. Sin embargo, es el MC más común en africanos y sus descendientes. Es frecuente también en asiáticos e hispanos. Surge en las palmas, plantas, dedos y debajo de las uñas.1,3,6,8
Otras variantes menos comunes son el melanoma amelanótico, melanoma de las mucosas, desmoplásico y neurotrópico.1
Diagnóstico e histopatología
Un buen historial médico y un examen físico a simple vista de una lesión ayudan a encontrar las características clásicas ABCDE de MC. Asimismo, el dermatoscopio magnifica la posibilidad de encontrar ciertas características en lesiones sospechosas para MC: patrón globular irregular, variación en la pigmentación, proyecciones irregulares en la periferia, velo azul grisáceo o azul blanquecino, estructuras de regresión (áreas de despigmentación con apariencia similar a una cicatriz) y vasos sanguíneos puntiformes o en forma de horquilla. Es importante palpar los ganglios locales para descartar presencia de linfadenopatía, así como realizar un examen de piel de cuerpo entero.1,3 Sin embargo, la biopsia escicional con 2-5 mm de márgenes es la manera de establecer el diagnóstico definitivo.8,9 Esta biopsia escisional puede ser elíptica, en sacabocado o de afeitada profunda, utilizando la técnica de saucerización.8
Histológicamente, los MC exhiben en la epidermis inferior y/o dermis nidos de melanocitos atípicos con núcleos hipercromáticos y polimórficos con nucléolos prominentes.8 Algunas lesiones melanocíticas son un reto y difíciles de distinguir histológicamente entre benignas o melanoma. Hay pruebas de inmunohistoquímica (S-100, Melan-A/MART-1, HMB-45, Ki-67, p16) y pruebas genéticas (hibridación genómica comparativa, hibridación in situ fluorescente o perfil de expresión génica) para definir la impresión histológica de melanoma. Sin embargo, ninguna de ellas es exclusivamente diagnóstica.10
El factor pronóstico más determinante en el MC es el grosor del tumor (Breslow’s thickness), seguido de la ulceración y la tasa de mitosis. Aunque la tasa mitótica no se incluye en la 8ª edición de AJCC, esta se reporta en los informes de patología, ya que sigue teniendo valor pronóstico. Además, si hay niveles de deshidrogenasa láctica (LDH) elevados en MC con metástasis a distancia la sobrevida es menor.11
Tratamiento
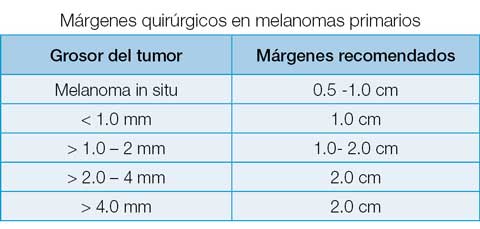
Las guías 2019 de National Comprehensive Cancer Network (NCCN) recomiendan que los MC in situ (MIS) se traten con escisión quirúrgica (EQ) con márgenes de 0.5 a 1.0 cm; los MC con grosor sobre 0.8 mm sin ulceración mediante EQ con margen de 1.0 cm, los de menos de 0.8 mm ulcerados o los sobre 0.8 mm –con o sin ulceración– deben tratarse mediante EQ con márgenes según su grosor y con biopsia de nódulo centinela.
Cuando hay nódulo centinela positivo, se debe hacer estudios de imágenes basales como PET/CT, MRI de cerebro o CT de tórax, abdomen y pelvis para buscar metástasis a distancia y clasificar el estadio. No obstante, estos estudios de imágenes se pueden realizar en cualquier etapa más temprana, de haber signos o síntomas que sugieran metástasis. Además, a estos pacientes se les pueden realizar pruebas genéticas para buscar mutación de BRAF V600, si se entiende que en un futuro se beneficiarán de terapias dirigidas contra esta mutación (dabrafenib / trametinib). Si hay nódulo centinela positivo, se puede hacer linfadenectomía formal u observar con pruebas de sonograma cada 4 meses los primeros 2 años y después cada 6 meses desde el tercer al quinto año.12 La linfadenectomía formal no ha probado mejorar la supervivencia en comparación con el seguimiento sonográfico.11,12
Los pacientes con nódulo centinela positivo sin metástasis a distancia deben recibir terapia adyuvante con anticuerpos monoclonales contra el receptor de PD-1 (nivolumab o pembrolizumab) o con inhibidores de tirosina cinasa (dabrafenib/trametinib) –cuando hay mutación en BRAF V600– para disminuir la recurrencia de melanoma, sobre todo si hay alto riesgo de recurrencia (tumor ulcerado y metástasis mayor a 1mm en nódulo centinela).12
Se recomienda una biopsia de aspiración con aguja fina o biopsia con aguja gruesa o biopsia escisional de los nódulos en pacientes de MC con nódulos clínicamente aparentes (palpables o detectados en estudios de imágenes) antes de la EQ con márgenes adecuados. De resultar positiva la biopsia, se realiza una linfadenectomía formal al momento de la EQ con márgenes del tumor primario. A estos pacientes se les ofrece terapia adyuvante irradiando (XRT) la cuenca de los nódulos linfáticos regionales + terapia sistémica con nivolumab o pembrolumab o dabrafenib/trametinib, con la finalidad de disminuir el riesgo de recurrencia. Sin embargo, los estudios revelan que la radioterapia siempre mejora la supervivencia o recurrencia.12
En casos de metástasis a distancia, se confirma con biopsia del foco de metástasis, realizando niveles de LDH en suero. Si la metástasis es resecable se le reseca y se administra terapia adyuvante (nivolumab o pembrolizumab). Si es irresecable, sin compromiso del cerebro, se puede considerar terapia sistémica con nivolumab o pembrolizumab o dabrafenib/trametinib (preferida en casos que necesiten una respuesta rápida y con mutación en BRAF V600), resección paliativa + XRT u hospicio. Cuando hay metástasis al cerebro, se puede considerar XRT a la lesión primaria, resección paliativa de la metástasis + XRT adyuvante a la metástasis cerebral, terapia sistémica con antiPD-1 o antitirosina cinasa u hospicio.12
Comentario
Se trata de un tipo de lesión maligna de la piel en la que las medidas preventivas son muy importantes, y en la que un diagnóstico temprano y un tratamiento cuidadoso son decisivos para el pronóstico.
Referencias
- Bolognia JL, Schaffer JV, Duncan KO, Ko, C. (2014). Cutaneous Melanoma. Dermatology Essentials (909-928). Elsevier Saunders.
- Gordon R. Skin cancer: an overview of epidemiology and risk factors. Semin Oncol Nurs. 2013; 29(3):160-169.
- Rastrelli M, Tropea S, Rossi CR, Alaiba M. Melanoma: Epidemiology, Risk Factors, Pathogenesis, Diagnosis and Classification. In Vivo. 2014; 28(6):1005-1011.
- Agosto-Rosa H, Torres-Cintrón CR, Ortiz-Alvarado M, Zavala D, Tortolero-Luna G, Ortiz AP. (2017). Melanoma de piel: Puerto Rico, 2010-2014. Registro Central de Cáncer, Centro Comprensivo de Cáncer, Universidad de Puerto Rico.
- NIH (2018). Cancer Stat Facts: Melanoma of the Skin. Accedido 23 enero 2019. https://seer.cancer.gov/statfacts/html/melan.html.
- Khan SA, Bank J, Song DH, Choi EA. (2015). The Skin and Subcutaneous Tissue. Schwartz’s Principles of Surgery. 10th Edition. McGraw-Hill Education.
- Tripathi SV, Morris CR, Alhamad T, Fields RC, Linette GP, Cornelius LA. Metastatic melanoma after solid organ transplantation: An interdisciplinary, institution-based review of management with systemic and targeted therapies. JAAcad Derm. 2018; 78(1):184-185.
- Sweeter S, Geller AC. (2018). Melanoma: Clinical features and diagnosis. UptoDate.
- Sladden MJ, Nieweg OE, Howle J, Coventry BJ, Thompson JF. Updated evidence-based clinical practice guidelines for the diagnosis and management of melanoma: definitive excision margins for primary cutaneous melanoma. Med J Aust. 2018;208(3):137-142.
- High WA. Detection of Genetic Aberrations in the Assessment and Prognosis of Melanoma. Dermatol Clin. 2017;35(4):525-536.
- Keung EZ, Balch CM, Gershenwald JE, Halpern AC. Key Changes in the AJCC 8th Edition Melanoma Staging System. The Melanoma Letter.2018;36(1):1-10.
- National Comprehensive Cancer Network. (2018). NCCN Clinical Practice Guidelines in Oncology. Cutaneous Melanoma. Version I.2019. Accedido 26 enero 2019. http://www.nccn.org