Nuevos avances en la enfermedad renal diabética

Michelle Mangual, MD
Endocrinóloga
Definición y epidemiología
El diagnóstico clínico de enfermedad renal diabética (ERD) se basa en la presencia de albuminuria, en la disminución en la tasa de filtración glomerular (TFG) o en ambos hallazgos en pacientes con diabetes. El término de nefropatía diabética, a su vez, se utiliza en presencia de lesiones glomerulares clásicas que se observan en pacientes con diabetes.
La ERD es, en la actualidad, la primera causa de enfermedad renal crónica (ERC) en el mundo y, también, de la progresión a fallo renal. Esta contribuye al exceso en mortalidad por cualquier causa y a la muerte por enfermedad cardiovascular que acompañan a la diabetes. La prevalencia de diabetes ha aumentado en forma muy significativa en los últimos años, alcanzando un 13.7% en Puerto Rico para el 2019 (según International Diabetes Federation). Se proyecta que, para el año 2040, uno de cada diez adultos o 642 millones de personas en todo el mundo tendrán diabetes.1
Cerca de la mitad de las personas con diabetes tipo 2 y un tercio de las personas con diabetes tipo 1 desarrollan enfermedad renal diabética.2 Para las personas con diabetes, la presencia de la enfermedad renal aumenta el riesgo de muerte entre 5 y 6 veces.3,4 Lamentablemente, cerca del 90% de los pacientes con ERD mueren antes de requerir terapia de reemplazo renal (TRR). Entre aquellos que llegan a la ERC, el riesgo de muerte es de 10 a 100 veces más alto que para las personas con una función renal normal.5 Aunque las tasas de supervivencia de los pacientes que reciben TRR han mejorado en las últimas décadas, el aumento del riesgo de muerte sigue siendo inaceptablemente alto, ya que un tercio de los pacientes tratados con diálisis de mantenimiento muere en los primeros 3 años del inicio de la terapia.6
Nuevas opciones terapéuticas
Estudios clínicos
En las últimas décadas se ha demostrado un beneficio significativo en cuanto a una reducción en la progresión de la insuficiencia renal utilizando antihipertensivos, como los inhibidores de la enzima convertidora de angiotensina (ECA) y los antagonistas del receptor de angiotensina II (ARA).
El estudio RENAAL con losartán demostró una reducción del 16% en el riesgo relativo de la progresión de la enfermedad renal, mientras que el estudio IDNT con irbesartán demostró una reducción del 20%. Aunque estos resultados son significativos, aún existe un riesgo residual de progresión de la enfermedad renal de un 40%.7,8
A partir de esta evidencia, se ha diseñado un sinnúmero de estudios clínicos con el fin de evaluar nuevas alternativas terapéuticas para así poder dirigir el tratamiento a los mecanismos fisiopatológicos que se asocian al desarrollo de la enfermedad renal.
Algunas de estas nuevas terapias incluyen: inhibición de la proteína quinasa C (PKC), tratamientos anti-age, tratamientos antifibróticos, antagonistas de endotelina, suplementos como vitamina D y tratamientos antihiperglucémicos.
Aspectos fisiopatológicos y efecto de SGLT2i
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT2i) fueron aprobados por la FDA en 2013 para mejorar el control glucémico en pacientes con diabetes mellitus tipo 2. En los estudios diseñados para demostrar la seguridad cardiovascular, se evaluó como un objetivo secundario la progresión de la enfermedad renal mediante la disminución en el doblaje de la creatinina sérica o la disminución en tasa de filtración glomerular (TFG), en el fallo renal y en muertes por causas renales. En estos estudios se demostró una reducción consistente (entre el 40% y el 47%) del riesgo relativo a través de toda la clase terapéutica.9-11
A partir de esta evidencia, se llevaron a cabo estudios diseñados específicamente para demostrar y confirmar este beneficio terapéutico: en el estudio DAPA-CKD12 con dapagliflozin en pacientes con y sin diabetes que incluía pacientes con TFG entre 25-75 ml/min/1.73m2 y con una razón de albumina a creatinina entre 200–5,000 mg/g; y en el estudio CREDENCE13 con canagliflozin en pacientes con diabetes con una TFG entre 30-90 ml/min/1.73m2 y con una razón de albumina a creatinina entre 300-5000 mg/g. La reducción del riesgo en la progresión de la enfermedad renal fue del 39% y del 34% respectivamente, ampliando la eficacia y la seguridad demostradas anteriormente, a una población con enfermedad renal avanzada. Esta evidencia nos ofrece una alternativa, tanto para la prevención como para el tratamiento de la ERD.
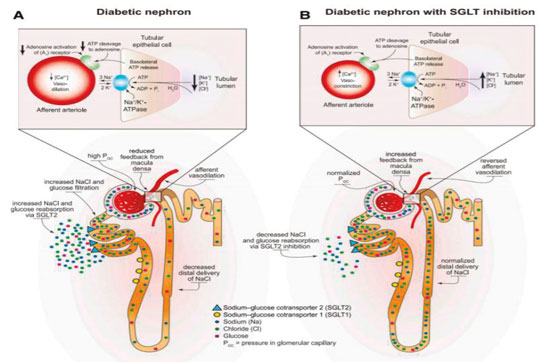
El beneficio renal observado con los SGLT2i es atribuido principalmente a la normalización en la hemodinámica glomerular a través de la restauración de la retroalimentación tubuloglomerular (Figura 1).
La hiperfiltración que resulta en hipertensión de la circulación capilar glomerular es un cambio hemodinámico temprano observado en al menos el 75% de los pacientes con diabetes tipo 1 y en un 40% de los pacientes que tienen diabetes tipo 2. La hiperfiltración glomerular está impulsada por alteraciones metabólicas, incluyendo la hiperglucemia, así como el aumento de la reabsorción tubular proximal de glucosa y sodio a través de SGLT1 y SGLT2.
La retroalimentación tubuloglomerular es un mecanismo adaptativo a través del cual la reabsorción de sodio en la mácula densa promueve la liberación de adenosina. Esta adenosina, a su vez, actúa de manera paracrina para contraer la arteriola aferente. En la diabetes, como resultado de un aumento en la reabsorción de sodio en la zona del túbulo proximal, la entrega a la mácula densa disminuye, lo que lleva a reducir la reabsorción de solutos y a la consiguiente disminución de producción de adenosina. Al promover la vasodilatación arteriolar aferente, se contribuye a la hiperperfusión, a la hipertensión y a la hiperfiltración glomerular en los pacientes con diabetes.
Sin embargo, al bloquear la reabsorción de sodio en el túbulo proximal, la inhibición de SGLT2 restablece el suministro de solutos a la mácula densa y, por lo tanto, restaura la retroalimentación tubuloglomerular normal. Esto tiene el efecto neto de revertir la vasodilatación aferente y de normalizar la hemodinámica glomerular.14 Se ha demostrado que este beneficio es independiente del control glucémico y que ocurrió en pacientes con o sin diabetes.
Agonistas de receptor de GLP-1
Otra clase terapéutica que también ha demostrado un beneficio en los resultados de la función renal en los pacientes con diabetes son los agonistas del receptor de GLP-1 (glucagon like peptide type 1 o péptido similar al glucagón tipo 1). En estos, el beneficio se ha observado principalmente mediante la disminución de la progresión de la macroalbuminuria, determinada como objetivo secundario de diferentes estudios.15 Algunos de los mecanismos propuestos en estudios preclínicos son la disminución en la expansión mesangial y el engrosamiento de la membrana basal glomerular, una protección endotelial y la restauración de podocitos.16
Comentario
Finalmente, la ERD es responsable de un aumento significativo en la morbilidad y en la mortalidad en pacientes con diabetes. Algunos nuevos tratamientos están siendo continuamente investigados.
Los SGLT2i y, en menor grado, los agonistas del receptor de GLP-1 han demostrado beneficios para evitar la progresión de la enfermedad renal y se deben considerar entre las alternativas de tratamiento para el control glucémico en los pacientes con diabetes, tanto para la prevención como para el tratamiento de la enfermedad renal.
Referencias
- International Diabetes Federation. IDF Diabetes Atlas, 9th edit [Internet], 2019. Available from http://diabetesatlas.org.
- Afkarian M, Zelnick LR, Hall YN, et al. Clinical manifestations of kidney disease among US adults with diabetes, 1988-2014. JAMA 2016; 316:602– 610.
- Afkarian M, Sachs MC, Kestenbaum B, et al. Kidney disease and increased mortality risk in type 2 diabetes. J Am Soc Nephrol 2013; 24:302–308.
- Rao Kondapally Seshasai S, Kaptoge S, Thompson A, et al.; Emerging Risk Factors Collaboration. Diabetes mellitus, fasting glucose, and risk of causespecific death. N Engl J Med 2011; 364:829–841.
- Couser WG, Remuzzi G, Mendis S, Tonelli M. The contribution of chronic kidney disease to the global burden of major noncommunicable diseases. Kidney Int 2011; 80:1258–1270.
- Storey BC, Staplin N, Harper CH, et al. Declining comorbidity-adjusted mortality rates in English patients receiving maintenance renal replacement therapy. Kidney Int 2018; 93:1165–1174.
- Brenner B, et al. Effects of Losartan on Renal and Cardiovascular Outcomes in Patients with Type 2 Diabetes and Nephropathy. N Engl J Med. 2001; 345:861-869.
- Lewis EJ, et al. Renoprotective Effect of the Angiotensin-Receptor Antagonist Irbesartan in Patients with Nephropathy Due to Type 2 Diabetes. N Engl J Med. 2001; 345:851-860.
- Wanner C, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016; 375:323-334.
- Neal B, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017; 377:644-657.
- Mosenzon O, et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE–TIMI 58 randomised trial. Lancet Diabetes Endocrinol. 2019; 7:606-617.
- Hiddo JL, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020; published online September 24,2020.
- Perkovic V, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019; 380:2295-2306.
- Alicic RZ, et al. Sodium-Glucose Cotransporter 2 Inhibition and Diabetic Kidney Disease. Diabetes. 2019; 68:248-257.
- Kristensen SL, et al. Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet Diabetes Endocrinol. 2019; 7:776785.
- Tanaka T, et al. The potential for renoprotection with incretin-based drugs. Kidney Int. 2014; 86:701-711.