Refuerzos de las vacunas contra el virus que causa COVID-19

María L. Santaella, MD, FAAAAI
Inmunología Clínica
Con la recomendación de la FDA y de los CDC sobre un segundo refuerzo de la vacuna contra SARS-CoV-2 para personas mayores de 50 años, se inició en los medios y a nivel científico una discusión sobre el tema. Las opiniones de diferentes expertos han sido variadas y hasta contrarias. Nos interesa aportar algunos datos y hacer unas observaciones sobre lo anterior, reconociendo que el grupo de personas mayores de 60 años tiene ciertas desventajas en su sistema de defensas.
Coronavirus
Los coronavirus humanos fueron identificados en la década de 1960. Su nombre surge de los picos (spikes) en su superficie, que forman una corona. Se han descrito 4 subgrupos: alfa, beta, gama y delta. Algunos pueden infectar animales y evolucionar a formas más severas como ha ocurrido con el SARS coronavirus (SARS-CoV), identificado en 2002, el MERS coronavirus (MERS-CoV) de 2012 y el SARS-CoV-2 de 2019, causante de la pandemia del COVID-19. Es importante señalar que un 20% de los catarros comunes son causados por coronavirus, que están en circulación todo el tiempo, lo que les permite mutar y, por lo tanto, cambiar sus características de infectividad y patogenicidad.
Al momento de este escrito, predomina la variante Ómicron BA.2, que es altamente contagiosa y por la cual China está sufriendo su peor brote. En Europa, al igual que en Puerto Rico, los casos relacionados con esa variante están en aumento. Recientemente se han identificado otras subvariantes de Ómicron, denominadas XE y XL, que aparentan ser más infecciosas que las variantes BA.1 y BA.2.
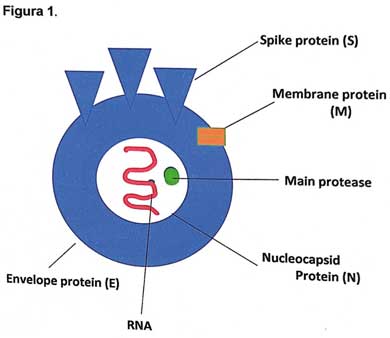
En la estructura del SARS-CoV-2, se observa que cualquier parte puede ser antigénica y reconocida como “algo extraño” que provoca una respuesta del sistema inmunitario (Figura 1). Hay partes que mutan rápidamente, como las proteínas de los picos (spikes). Las variantes que surgen por estas mutaciones tienen el efecto de “burlar” el sistema inmunitario.
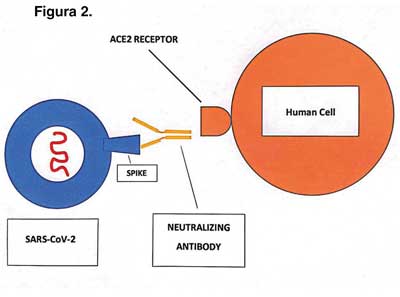
El virus entra a nuestras células a través del receptor para el inhibidor de la enzima convertidora de angiotensina 2 (ACE-2). Los anticuerpos neutralizantes, cuya producción se estimula con las vacunas a base de material del virus –las proteínas de los spikes–, evitan ese ingreso. (Figura 2)
El sistema inmunitario y el SARS-CoV-2
El sistema inmunitario es el sistema de defensa del cuerpo. Básicamente consta de 2 grandes divisiones: la inmunidad innata y la inmunidad adaptativa. La primera consta de: barreras anatómicas y químicas (como la piel, la mucosa nasal, la mucosa gastrointestinal, etc.), los macrófagos y los fagocitos circulantes, las proteínas (sistema de complemento) y los linfocitos NK (natural killer), y las citoquinas. La segunda división es la inmunidad adquirida, que entra en función más tarde y funciona a base de células especializadas para producir una respuesta de defensa más duradera y específica. Las células del sistema de inmunidad adquirida son mayormente linfocitos T (funcionan a base de citoquinas) y linfocitos B (participan en la producción de anticuerpos).
A su vez, los linfocitos T se subdividen mayormente en dos grandes grupos: los que colaboran (T CD4+, T helper) o los que suprimen (T CD8+, T suppressor) las respuestas inmunitarias. Los T CD4+ se dividen en Th1 y Th2, entre otros. Los Th1 participan en las respuestas de inmunidad celular (mediadas por citoquinas) y, los Th2, en las respuestas de inmunidad humoral (producción de anticuerpos).
En la infección por SARS-CoV-2, el sistema inmunitario responde con todos sus componentes, tanto de inmunidad innata como de inmunidad adaptativa. Algo interesante con este virus es que tiene mecanismos para alterar y evadir los componentes de la inmunidad innata, lo que le da ventaja como invasor. La inmunidad adaptativa también entra en función y hay estudios que sugieren una respuesta de linfocitos T que reconoce el virus hasta 8 meses después de la infección. Varios estudios señalan que el desbalance entre las poblaciones Th1 y Th2, con la consecuente variación en la producción de citoquinas, predice el curso de la persona infectada por el SARS-CoV-2.
En ocasiones, la respuesta inmunitaria al SARS-Cov-2 puede ser muy exagerada y producir una respuesta llamada “tormenta de citoquinas”, que puede llevar a los estados más severos de la entidad clínica (síndromes inflamatorios sistémicos).
Una interrogante aún no aclarada es por qué no se logra una inmunidad permanente luego de una primera infección con SARS-CoV-2 o con la vacunación. Una explicación en torno a este asunto sería la pérdida de células de memoria que usualmente se generan tras una infección y/o luego de una vacunación. Estas son mayormente linfocitos T o B capaces de guardar “la memoria” de un invasor –como un virus– y que, al reencontrarse con el invasor, responden de forma rápida y efectiva (respuesta inmune secundaria). Las células de memoria se encuentran en la circulación, la médula ósea, el bazo, y los tejidos linfoides del cuerpo. En el poco tiempo de experiencia con el virus SARS-CoV-2 se ha observado una disminución preferencial de células de memoria B.
El sistema inmunitario y la edad
La geriatría considera a una persona en el grupo de edad avanzada a aquella mayor de 65 años. Se han descrito alteraciones en casi todos los componentes del sistema inmunitario según se avanza en edad:
- Hay una respuesta más lenta y/o menos intensa a estímulos antigénicos (como bacterias, virus, etc.);
- Hay mayor predisposición a desarrollar condiciones de autoinmunidad (cuando el sistema inmunitario “se equivoca” y ataca a las células propias);
- El proceso de sanar los tejidos es más lento, ya que hay menos células para hacerlo;
- Disminuye la habilidad para detectar y/o corregir defectos, aumentando la incidencia de malignidades; y
- Se afectan los parámetros inmunitarios en general: menor capacidad de fagocitosis, trastornos en la recepción de antígenos por células dendríticas, pérdida de células T viables, menor y más lenta producción de anticuerpos y disminución de células de memoria, entre otros.
Argumentos en contra del segundo refuerzo
Hasta el presente, hay básicamente dos estudios de Israel en los cuales se basa la recomendación del segundo refuerzo (4ª dosis) para personas mayores de 60 años. El primero examinó la tasa de infección y enfermedad severa en un banco de datos de más de un millón de personas de 60 años o más: demostró que el riesgo de mortalidad por COVID-19 se redujo significativamente en quienes recibieron un segundo refuerzo versus aquellos que solamente recibieron 3 dosis de la vacuna. Las hospitalizaciones fueron 4 veces menos en los vacunados con el segundo refuerzo en comparación con los vacunados solo con el primer refuerzo (3ª dosis). De igual forma, la severidad de la condición fue 3.5 veces menor en el grupo que recibió la 4ª dosis comparada con el grupo que solamente había recibido la 3ª dosis. La protección por efecto de la vacuna duró por lo menos 12 semanas, que fue el tiempo en que finalizó el estudio.
El segundo estudio fue en una población más joven, de 274 cuidadores de la salud: demostró que los niveles de anticuerpos obtenidos con la 3ª dosis y que habían disminuido con el tiempo, pudieron recuperarse con la 4ª dosis. No se demostró una menor incidencia de infección con la variante Ómicron.
En ninguno de estos estudios hubo mayor frecuencia de efectos adversos a los ya reportados cuando los participantes recibieron las primeras 3 dosis de la vacuna. En ambos estudios, los niveles de anticuerpos alcanzados tras la 4ª dosis fueron similares –pero no más altos– a los observados después de la 3ª dosis. Este hecho ha sido señalado por algunos expertos para no justificar la administración de la 4ª dosis. Sin embargo, se debe recordar que todos los refuerzos que se utilizan son a base del material viral del primer caso identificado de COVID-19 en los Estados Unidos (WA1/2020), lo que podría explicar una menor producción de anticuerpos neutralizantes en presencia de nuevas variantes (BA.1 y BA.2). Otro aspecto importante es que se desconoce cuál es el nivel de anticuerpos neutralizantes que protege a la mayor parte de la población. Es concebible que exista un umbral (threshold) protector de anticuerpos neutralizantes.
Otros argumentos aducidos contra la 4ª dosis son la escasez de estudios y, además, que no hay datos sobre la duración de niveles de anticuerpos tras el refuerzo por un periodo mayor a 12 semanas. Definitivamente se requieren más tiempo y un mayor número de datos confiables para responder con certeza a estas inquietudes. Pero lo que sí está constatado es que los niveles de anticuerpos tras la 3a dosis disminuyen en 4 meses hasta un 78% y a un 54% a los 4 meses de las primeras 2 dosis (CDC, MMWR, feb, 2022).
Otro argumento presentado por los opositores a la 4ª dosis es que, si luego ocurre otra ola de casos, las personas vacunadas ahora ya no tendrán suficientes niveles de anticuerpos para el verano o el otoño. Pero indudablemente nadie podría predecir esto.
El grupo que se opone también propone que podrían surgir variantes para las cuales no hubiera protección con las vacunas actuales. Sin embargo, hasta hoy las vacunas han logrado mantener las variantes del virus bajo cierto control. Siempre hay la posibilidad de escape al efecto de la vacuna por una variante, pero esto no tiene nada que ver con la posposición de la 4ª dosis.
Finalmente, otro argumento levantado en contra de la 4ª dosis es cuánto podrían tolerar las personas mayores los efectos secundarios asociados a la vacunación (molestia en el lugar de inyección, dolor muscular, fiebre, cansancio, etc.). No obstante, hay remedios sencillos para estas situaciones. Ese argumento solo podría sostenerse en casos de reacción alérgica severa.
Se mencionan mecanismos y/o procesos inmunitarios que en teoría pudieran alterarse tras los refuerzos:
- Agotamiento inmunitario (Immune exhaustion): en teoría, podría ocurrir si las células del sistema inmune de la persona expuesta a los refuerzos se “agotaran” dejando de producir citoquinas y anticuerpos tras encontrar el virus nuevamente. No se ha observado esto. Luego de la 3ª dosis, la producción de anticuerpos fue mayor que después de las primeras dos dosis. La respuesta a la 4ª dosis fue adecuada pero no mayor que luego de la 3ª dosis;
- Impresión (Imprinting): ocurriría si la exposición repetida al SARS-Cov-2 limitara la capacidad del cuerpo de reconocer nuevas variantes. Esto no ha sido documentado hasta el momento;
- La hipótesis según la cual recibir dosis adicionales de antígeno podría interferir con la producción de células plasmáticas (que producen anticuerpos): no se ha documentado. Espaciar los refuerzos hasta que los anticuerpos bajen intenta evitar que esto ocurra; y
- Que el efecto de una vacuna ante nuevas variantes (proteínas distintas) pueda alterarse por la respuesta a dosis anteriores: la producción de anticuerpos por dosis adicionales de antígeno se conserva aún en presencia de nuevas variantes (efectividad del primer refuerzo en la época de la variante Ómicron BA.2). El efecto sobre la severidad de la condición, las hospitalizaciones y las muertes se ha conservado aun tras la 4ª dosis (y ante nuevas variantes).
Argumentos a favor del segundo refuerzo
Las tasas de infección por SARS-CoV-2 se mantienen significativamente altas en diversos países y Puerto Rico no es la excepción. España, Italia, Inglaterra, Finlandia e Israel, entre otros, ya están administrando la 4a dosis por el aumento de infecciones. El Dr. Carlos del Río, infectólogo de la Universidad de Emory, sostiene el dato, corroborado por estudios, que las personas mayores de 65 años, aun estando vacunadas, tienen un mayor riesgo de muerte por infecciones por SARS-CoV-2 que las personas de menor edad.
Estudios sostienen que el segundo refuerzo disminuye la ocurrencia de enfermedad severa y muerte –hasta el tiempo observado– en mayores de 60 años al compararlos con personas no-vacunadas de la misma edad. Los estudios de las vacunas Pfizer y Moderna demuestran una disminución significativa en los niveles de anticuerpos a 4 meses del primer refuerzo, lo que apoya la administración de una 4ª dosis.
Esperar a una nueva ola o a que se identifique una nueva variante no es razonable para personas con un sistema inmunitario comprometido. Se reitera que, aunque las variantes existentes al momento sean más inocuas, no se puede predecir cuándo podría presentarse una mutación más patogénica.
El deterioro en el sistema inmunitario en personas sobre los 60 años está bien documentado por numerosos estudios. A esto se puede añadir la contribución negativa que conlleva padecer condiciones subyacentes más comunes en personas mayores como: enfermedad cardiovascular, enfermedad crónica pulmonar, enfermedad renal, diabetes e hipertensión, las que de por sí acarrean mayor mortalidad.
Otro dato importante a favor del segundo refuerzo es que el COVID prolongado (long COVID) puede ocurrir en personas que han tenido un cuadro de COVID-19 leve. Los CDC han definido esta condición como la persistencia de síntomas por 4 semanas o más después de la infección. La frecuencia de esta condición varía de un estudio a otro, pero se ha encontrado en hasta un 67% de las personas con COVID-19 leve. De acuerdo a esa organización, los síntomas de COVID prolongado son: fatiga, falta de aire, tos, dolores en las articulaciones y dolor de pecho. También pueden haber casos de personas que no puedan pensar con claridad ni mantenerse enfocadas (brain fog), depresión, dolores musculares, dolor de cabeza, fiebre intermitente, palpitaciones, afección de órganos como el músculo cardiaco (inflamación y miocarditis), la función pulmonar, haber daño renal, erupciones, pérdida de pelo, afectación del sistema nervioso, incluyendo sangrado y coágulos cerebrales, daño a los nervios, meningitis y pérdida prolongada del gusto y del olfato. Hasta la fecha, no hay manera de predecir que puedan ocurrir estas complicaciones.
Las vacunas existentes
La búsqueda de una vacuna similar a la de influenza –en términos de que sea anual– no ha sido fácil, ya que el virus SARS-CoV-2 se ha caracterizado por mutar a una velocidad 5 veces mayor que el de la influenza, produciendo por lo menos una variante dominante por año. Al virus de influenza le toma de 3 a 5 años producir una nueva variante. Tampoco se ha podido producir una vacuna como aquella contra el sarampión, que evita la infección con el virus confiriendo inmunidad de por vida (inmunidad esterilizante). Con las vacunas actuales, los niveles de anticuerpos no se mantienen luego de 4 meses de la inoculación. Pero al menos, se han documentado efectos positivos en cuanto a disminución en la severidad de la condición, las hospitalizaciones y las muertes.
Tres situaciones en torno a la pandemia de COVID-19 son responsables de que las vacunas existentes no sean totalmente efectivas: el virus muta frecuentemente; la vacunación no ha llegado al nivel necesario para que las vacunas disponibles sean totalmente efectivas; y las vacunas existentes están basadas en la producción de anticuerpos contra la proteína de los picos (spikes) del virus. Esta región del virus es muy inestable y cambiante, y, por lo tanto, evade con facilidad la acción neutralizante del anticuerpo producido contra ella. Mientras más contagiosas sean las futuras variantes del virus, mayor deberá ser la población completamente vacunada para impedir su transmisión. Lograr que una cantidad significativa de personas acuda a vacunarse unas tres veces al año no es ni atractivo ni cómodo para muchos. Para lograr ese objetivo, se requieren, además, consideraciones de logística y de costos. A pesar de lo anterior, hay una gran posibilidad de que se recomiende otro refuerzo con las vacunas existentes al presente para el otoño, de no lograrse crear y aprobar vacunas más específicas y efectivas contra las variantes presentes en ese momento.
Actualmente, se trabaja en la creación de vacunas que estimulen la producción de anticuerpos contra regiones más estables del virus (como la base de los picos); vacunas que se introduzcan por la vía nasal para que aumenten la inmunidad a ese nivel (por donde entra el virus); y otras que tengan una base de proteínas para mejor protección y duración de su efecto. Las vacunas actuales usan nanopartículas de lípidos para llevar el material del virus, actuando como adyuvantes. Se desconoce si estas partículas puedan afectar la respuesta inmunitaria a largo plazo. A pesar de no tener la vacuna ideal aún, los hallazgos de estudios en poblaciones vacunadas versus no vacunadas ciertamente favorecen el hecho de que se administren refuerzos programados, en especial en personas de mayor edad.
Referencias
- Yuki K, Fujiogi M, Koutsogiannaki S. COVID-19 Pathophysiology: A Review. Clin Immunol. 2020, Jun 215: 108427.
- Chowdhury MA, Hossain N, Kashem MA, et al. Immune response in COVID-19: A Review. J Infect Public Health 2020; Nov 13(11): 1619.
- Gil FJ, Suárez P, Cabrera O, et al. T-helper cell subset response is a determining factor in COVID-19 progression. Front Cell Infect Microbiol 2021; Feb 26:11: 624483.
- Oh SJ, Lee JK, Shin OS. Aging and the immune system: The impact of immunosenescence on viral infection, immunity and vaccine immunogenicity. Immune Network 2019; Dec 19(6): e37.
- Bar-On YM, Goldberg Y, Mandel M, et al. Protection by a 4th dose of BNT162b2 against Omicron in Israel. NEJM; April 5, 2022.
- Yochay GR, Gonen T, Gilboa M, et al. Efficacy of fourth dose of COVID-19 mRNA vaccine against Omicron. NEJM; March 16, 2022.
- Shah VK, Firnal P, Alam A, et al. Overview of immune responses during SARS-Cov-2 Infection: Front Immunol. 2020, 11:1949.
- Ricci D, Etna MP, Rizzo F, et al. Innate immune response to SARS-Cov-2 infection. Int J Mol Sci 2021 Jul 22(13): 7017.
- Dan JM, Mateus J, et al. Immunological memory to SARS-CoV-2 assessed for 8 months after infection. Science 2021 Feb 5:37(6529).
- Rha MS, Shin EC. Activation or exhaustion of CD8 T cells in patients with COVID-19. Cellular and Molecul Immunol. 2021; Aug 18: 2325.
- Wheatley AK, Fox A, Tan HX, et al. Immune imprinting and SARS-CoV-2 vaccine design. Trends Immunol 2021; Nov 42(11): 956.
- Vu MN, Kelly HG, Ken SJ, Wheatley AK. Current and future nanoparticle vaccines for COVID-19. EBio Med 2021; Dec: 103699.
- CDC. Understanding mRNA COVID-19 vaccines. Jan 4, 2022.