Síndrome de apnea obstructiva en cuidados intensivos pediátricos

José Rodríguez-Santana, MD, FAAP, FCCP
Neumólogo e Intensivista Pediátrico
Grupo Intensivo Pediátrico
Centro de Neumología Pediátrica, San Juan
Resumen
El síndrome de apnea obstructiva del sueño (SAOS), bien conocido en adultos, sigue sin ser bien identificado en muchos niños. Describimos acá algunos detalles del diagnóstico y manejo del SAOS en unidades de cuidado intensivo pediátrico (PICU). Con los avances en monitoreo, estudios de imágenes, pruebas diagnósticas y mayor uso de ventilación no invasiva en niños, han disminuido las complicaciones asociadas al SAOS en PICU. Por lo complejo de estos casos, aún hay retos en el diagnóstico, manejo e integración al equipo multidisciplinario.
Introducción
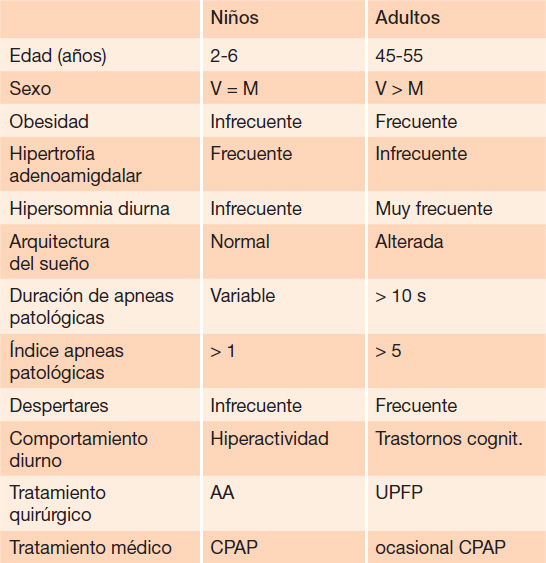
El SAOS se define como un desorden de la respiración durante el sueño, con obstrucción parcial prolongada de la vía aérea superior y/o obstrucción completa intermitente (apnea obstructiva) que altera la ventilación normal durante el sueño. Los síntomas concomitantes son: ronquido habitual nocturno, dificultad en el sueño y/o problemas de conducta diurnos. Hay distintos grados, de trastornos de sueño, desde el ronquido primario (RP) sin apneas, hipoventilación y/o hipoxemia, sin alteración del sueño ni síntomas diurnos, hasta la obstrucción severa de la vía aérea con desaturación, periodos de hipopnea y apnea, hasta trastornos cognoscitivos y de comportamiento. Hay un cuadro intermedio, el síndrome de resistencia de la vía aérea superior (UARS), en que los niños roncan y tienen obstrucción parcial de la vía aérea superior, con episodios de mayor esfuerzo respiratorio y un microdespertar. No tienen apneas, hipopneas ni alteraciones del intercambio gaseoso, pero sí tienen el patrón del sueño alterado. Los factores que predisponen al RP son los mismos que en el SAOS; el más frecuente, la hipertrofia de amígdalas. La prevalencia del RP es de 10-12% y la del SAOS de 0,7-3%, en la mayoría de los estudios publicados. La prevalencia máxima está entre los 2 y 8 años, cuando el tejido adenoamigdalar es mayor respecto al volumen de las vías respiratorias. Hay grandes diferencias cuando esto se da en niños o adultos (Tabla 1). La clásica descripción del paciente obeso, roncador y con somnolencia diurna es rara en niños, pero es un reto en PICU. La hipertrofia adenoamigdalar es la causa más frecuente en niños, mientras que en el adulto el colapso es en la úvula, en el paladar blando y en la pared faríngea posterior.
Tabla 1 Diferencias entre niños y adultos
Factores que predisponen
Los factores que predisponen a SAOS infantil son los que afectan a la vía aérea (anatómicos) o su control neurológico (funcional). En condiciones normales hay equilibrio entre la presión negativa inspiratoria, que tiende al colapso de la vía aérea, y su distensión por los músculos dilatadores faríngeos.
El factor anatómico más importante es la hipertrofia adenoamigdalar, además de la obstrucción nasal, la macroglosia, el reflujo gastroesofágico, la obesidad, la cirugía del paladar hendido, la laringomalacia y las anomalías craneofaciales o algunos síndromes genéticos (como acondroplasia, síndromes de Apert, de Crouzon, de Beckwith-Wiedemann, de Down, entre otros).
El factor funcional más significativo es la hipotonía faríngea en fase REM, además de infecciones repetidas de vías respiratorias, alteraciones neuromusculares (distrofias musculares, parálisis cerebral), hipotiroidismo, accidentes cerebrovasculares, medicamentos y drogas.
Sintomatología
El síntoma característico es el ronquido, aunque también se observan pausas respiratorias, agitación con movimientos, intranquilidad, sudoración por el esfuerzo respiratorio y enuresis. Durante el día, la mayoría de los niños no muestran síntomas, pero puede haber trastornos de comportamiento, además de los típicos síntomas causados por la hipertrofia adenoamigdalar. No es raro encontrar en PICU casos sin diagnóstico con síntomas de SOAS. Es importante su identificación temprana para el manejo de una vía aérea difícil y los riesgos antes, durante y después de una cirugía (cor pulmonale, edema pulmonar).
Diagnóstico
No hay signos patognomónicos para distinguir el SAOS del RP, por lo que la polisomnografía (PSG) nocturna es indicada para el diagnóstico del SAOS. Sin embargo, es raro realizar esta prueba en PICU. Por ello, el manejo se basará en la alta sospecha clínica del síndrome, en estudios de imágenes, en ecocardiograma, en gases arteriales, oximetría de pulso y capnografía. Las desaturaciones bajo 90% tienen hasta un 97 % de valor predictivo positivo para SAOS en niños sin otro problema de salud. Las grabaciones de audio y video en el hogar ayudan al clínico a sospechar del SAOS.
Tratamiento
Muchos casos severos admitidos en PICU requieren un manejo multidisciplinario por su complejidad.
La adenoamigdalectomía (AA) es el tratamiento de elección en niños con hipertrofia adenoamigdalar; tiene una tasa de curación del 83%, pero no es efectiva siempre. Los niños con SAOS severo tienen la peor tasa de curación tras AA. La uvulopalato -faringoplastia, es una técnica poco utilizada en niños; en Europa se suele hacer en enfermedades neuromusculares, parálisis cerebral y accidentes cerebrovasculares.
La traqueotomía se usa en pacientes con déficit neurológico y anomalías craneofaciales graves. Se suele mantener hasta que finaliza el crecimiento o hasta que se produzca algún tipo de cirugía que permita la decanulación. Usar una válvula parlativa es importante cuando hay traqueotomía, para disminuir las limitaciones del habla. El uso de un tubo nasofaríngeo temporero es necesario en algunos casos. El tratamiento ortodóncico, usado en adultos, no es la primera opción en niños.
La cirugía craneofacial generalmente se realiza en la adolescencia logrando en algunos casos la decanulacion y resolución del SAOS. No está libre de complicaciones y el riesgo oscila entre el 0,1 y el 3%, aumentando hasta 27% en SAOS. Sus complicaciones, las desaturaciones, el edema pulmonar, el neumotórax y los sangrados aumentan el riesgo en menores de 3 años de edad. Por eso, el manejo postquirúrgico de niños con SAOS o con riesgo de complicaciones debe hacerse en unidades que puedan resolverlas, como son las PICU.
En PICU una de las modalidades de ventilación no invasiva más utilizada en el SAOS es la presión positiva continua en vía aérea (CPAP/BiLevel), que ha demostrado ser un dispositivo seguro. Se utiliza como tratamiento primario en anomalías cráneo-faciales, trastornos neuromusculares, síndromes genéticos, displasias óseas y obesidad. Es una alternativa a la traqueotomía. En otras ocasiones se utiliza para estabilizar al paciente y proceder con la cirugía. Los efectos secundarios más graves e infrecuentes son la hipoplasia facial y la hipoventilación.
Referencias
- Carole L. Marcus, Lee Jay Brooks, Kari A. Draper, et al. Diagnosis and Management of Childhood Obstructive Sleep Apnea Syndrome Pediatrics 2012;130:576–584.
- Primhak R, O’Brien C. Sleep apnoea. Arch Dis Child Educ Pract Ed. 2005;90:87-91.
- Guilleminault C, Lee JH, Chan A. Pediatric obstructive sleep apnea syndrome. Arch Pediatr Adolesc Med.2005;159:775-85.
- Tal A, Bar A, Leiberman A. Sleep characteristics following adenotondillectomy in children with obstructive sleep apnea syndrome. Chest. 2003;124:948-53.
- Nixon GM, Kermack AS, Davis GM, Manoukian JJ. Planning adenotonsillectomy in children with obstructive sleep apnea: The role of overnight oximetry. Pediatrics. 2004;113:19-25.
- Mitchell RB. Adenotonsillectomy for obstructive sleep apnea in children: outcome evaluated by pre-and postoperative polysomnography. Laryngoscope. 2007;117:1844-54.