ONCOLOGÍA: SUPLEMENTO LEUCEMIA
Trasplante de médula ósea:
Pieza clave en el tratamiento de la leucemia mielógena aguda (AML)

Alexis M. Cruz Chacón, MD, FACP
Hematólogo Oncólogo
Especialista en Trasplante de Médula Ósea de pacientes adultos
Director Médico, Programa de Trasplante de Médula Ósea, Hospital Auxilio Mutuo
Clínica de Malignidades Hematológicas, Hospital Centro Compresivo de Cáncer de la UPR
El trasplante de progenitores hematopoyéticos (TPH), –comúnmente conocido como trasplante de médula ósea– es un tratamiento utilizado primordialmente en el manejo de malignidades hematológicas. El mismo consiste en la infusión de células precursoras hematopoyéticas –también conocidas como células madre– a un recipiente con el propósito de repoblar o reemplazar su sistema hematopoyético.
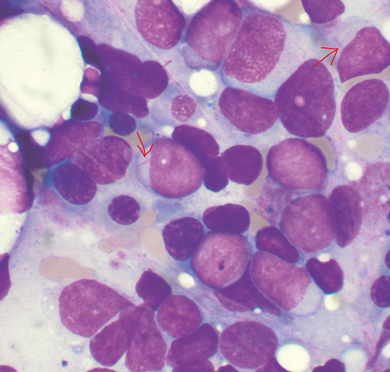
A pesar de que la mayoría de los pacientes con leucemia mielógena aguda (AML) que son tratados con quimioterapia intensa alcanzan una remisión completa, muchos están a riesgo de recaída de ser tratados solo con esta modalidad. El trasplante de medula ósea del tipo alogénico, donde se utilizan células madre de un donante compatible, es una estrategia de tratamiento que ha demostrado ser efectiva para ofrecer una mayor posibilidad de cura a los pacientes con AML.
Tipos de trasplante de progenitores hematopoyéticos
Existen varios tipos de TPH, dependiendo del donante o de la fuente de los progenitores hematopoyéticos (PH).
En un TPH autólogo, los PH provienen del propio paciente. El propósito de un TPH autólogo es permitir la administración de quimioterapia en dosis elevadas, evitando una mielosupresión prolongada o irreversible mediante la administración de PH que ayuda a recuperar la médula ósea del propio paciente.
En un TPH alogénico, los PH provienen de un donante sano (puede ser un familiar o un desconocido). El objetivo de un TPH alogénico es sustituir la médula ósea de un paciente que se encuentra defectuosa, insuficiente o neoplásica con una normal, procedente de un donante sano.
Contrariamente al TPH autólogo, el TPH alogénico requiere que haya compatibilidad de genes HLA entre el donante y el receptor, y que se administre al paciente una terapia de inmunosupresión. El beneficio de un trasplante alogénico no solo recae en el efecto anticáncer de la quimioterapia, sino también en la actividad antitumoral de las células inmunocompetentes presentes en el trasplante y en la reinicialización del sistema inmunitario.
Fuente de progenitores hematopoyéticos
Los TPH pueden realizarse a partir de 3 distintas fuentes de progenitores hematopoyéticos (PH):
- En los inicios del TPH, el método utilizado fue extraer los PH directamente de la médula ósea a través de la punción múltiple y de aspiración del hueso pélvico. Este procedimiento es doloroso (equivalente a 50-100 biopsias de médula ósea) y requiere anestesia general;
- Actualmente, en la gran mayoría de los trasplantes los PH se obtienen de la sangre periférica a través del proceso de aféresis. Esto es posible gracias a que los PH pueden ser movilizados de la médula ósea a la circulación periférica mediante el uso de medicamentos. Este procedimiento es mucho más seguro y rápido y, además, permite obtener un mayor número de PH; y
- Otra fuente de PH es la sangre de cordón umbilical, pero es menos utilizada debido a limitaciones como una menor cantidad de PH y falta de experiencia en la mayoría de los centros.
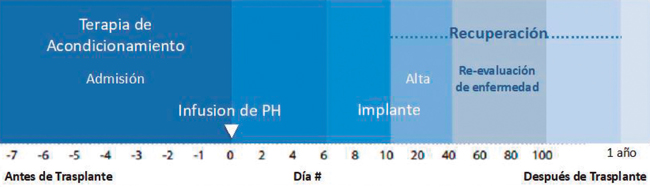
Terapia de acondicionamiento
Se conoce como quimioterapia de acondicionamiento al tratamiento recibido por el receptor previo a la infusión de los progenitores hemopoyéticos. Puede consistir de quimioterapia, de radioterapia o de una combinación de ambas. Existen numerosas combinaciones que se diferencian por la intensidad del tratamiento. Al incrementar la intensidad, aumentan la toxicidad y la mortalidad. Se define como un régimen mieloablativo aquel de mayor intensidad que elimina la mayor parte de las células hematopoyéticas del receptor. En la actualidad, se utilizan regímenes de intensidad reducida que, al tener dosis más bajas de quimioterapia, tienen menor toxicidad y son mejor tolerados por el paciente. El uso de regímenes de intensidad reducida ha contribuido a expandir el uso de TPH a pacientes de mayor edad, los que anteriormente no se consideraban candidatos adecuados para este tratamiento.
El trasplante
Una vez completada la terapia de acondicionamiento, se infunden al paciente los progenitores hematopoyéticos de forma similar a una trasfusión de sangre. Luego, sigue una fase aplásica de aproximadamente 2 semanas, donde los conteos de las células de la sangre se mantienen disminuidos. Durante este periodo, el paciente se encuentra en mayor riesgo de complicaciones debido a la toxicidad del acondicionamiento y a la intensa mielosupresión incluyendo mucositis, náusea, diarrea, enteritis, infección, sangrado, fallo renal o hepático, entre otras. El manejo de estas complicaciones ha mejorado significativamente en las últimas décadas gracias al desarrollo de mejores medicamentos, antibióticos y pruebas de monitoreo.
Trasplante de medula ósea en el tratamiento de leucemia mielógena aguda (AML)
A pesar de los nuevos avances y agentes que han sido aprobados para el tratamiento de AML en la última década, el TPH alogénico sigue siendo un componente fundamental en el manejo de pacientes que alcanzan una remisión o tienen enfermedad avanzada.
El beneficio del TPH alogénico contra la AML recae en la intensificación de la quimioterapia y el desarrollo en el paciente de un potente sistema inmunológico capaz de atacar el cáncer de una forma más eficaz y efectiva (conocido como el efecto injerto vs leucemia). En aquellos pacientes de AML que son catalogados como de riesgo alto o intermedio, de acuerdo con la presencia de anormalidades genéticas o mutaciones específicas, se requiere de la realización de un TPH alogénico para obtener la mayor probabilidad de cura. Estos pacientes están destinados a recaer si son tratados solo con quimioterapia.
A pesar de que la mortalidad asociada al trasplante ha disminuido significativamente en las últimas décadas, no ha habido un progreso similar en la reducción del riesgo de recaída de enfermedad, que sigue siendo la principal causa de fracaso del trasplante y aún representa un área de necesidad.
Entre los esfuerzos realizados para intentar reducir la recaída de la enfermedad, están los avances en la quimioterapia de inducción, el desarrollo de nuevos regímenes de acondicionamiento y la utilización de terapias de mantenimiento postrasplante. La utilización de anormalidades genéticas y mutaciones como marcadores para detectar y medir la enfermedad residual también ha ayudado a identificar mejor a aquellos pacientes con AML que se benefician de un TPH alogénico.
La mayor disponibilidad de donantes y la utilización de regímenes de acondicionamiento de intensidad reducida han contribuido a aumentar el acceso de los pacientes al trasplante de medula ósea.
En Puerto Rico, desde el año 2017, el TPH alogénico se realiza en el Hospital Auxilio Mutuo, lo que ha maximizado las opciones de tratamiento para los pacientes con AML de nuestra isla. Hasta el momento, se han llevado a cabo un total de 82 trasplantes de tipo alogénico en el programa, de los cuales un tercio (34%) han sido a pacientes con AML.
Conclusión
El trasplante de progenitores hematopoyéticos del tipo alogénico continúa siendo una pieza clave en el tratamiento de pacientes con leucemia mielógena aguda. Con el paso de los años, la mortalidad asociada a este procedimiento ha disminuido significativamente gracias al mejor entendimiento de la biología involucrada en el proceso, a la utilización de regímenes de acondicionamiento menos tóxicos y al desarrollo de mejores medicamentos, antibióticos y pruebas de monitoreo. Gracias a esto, se ha logrado expandir significativamente la cantidad de pacientes que se pueden beneficiar del mismo. El futuro progreso de este tratamiento dependerá del desarrollo de estudios clínicos que permitan integrar las nuevas terapias y pruebas de detección con el mismo.
Referencias
- Copelan EA. Hematopoietic Stem-Cell Transplantation. N Engl J Med. (2006); 354: 1813-26.
- Snowden JA, et al. Indications for haematopoietic cell transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2022. Bone Marrow Transplantation. (2022) 57: 1217–1239.
- Loke J, et al. Allogeneic Stem Cell Transplantation for Acute Myeloid Leukemia: Who, When, and How? Front. Immunol. (2021) 12: 659595.
- Bittencourt MC, Ciurea SO. Recent Advances in Allogeneic Hematopoietic Stem Cell Transplantation for Acute Myeloid Leukemia. Biol Blood Marrow Transplant. 26 (2020): e215e221.
- Duarte RF, et al. Indications for hematopoietic stem cell transplant for hematological diseases, solid tumors and immune disorders. Bone Marrow Transpl. 2019;54: 1525–52.
- Shouval R, Fein JA, et al. External validation and comparison of multiple prognostic scores in allogeneic hematopoietic stem cell transplantation. Blood Adv. 2019;3: 1881–90.
- McDonald GB, et al. Survival, nonrelapse mortality, and relapse-related mortality after allogeneic hematopoietic cell transplantation: comparing 2003-2007 versus 2013-2017 cohorts. Ann Intern Med. 2020;172:229–39.
- Döhner H, Estey E, et al. Diagnosis and management of AML in adults. Blood. 2017;129:424–47.
- Canaani J, Labopin M, et al. Prognostic significance of recurring chromosomal abnormalities in transplanted patients with acute myeloid leukemia. Leukemia. 2019;33: 1944–52.
- Papaemmanuil E, et al. Genomic classification and prognosis in AML. N Engl J Med. 2016;374: 2209–21.
- Cornelissen JJ, Blaise D. Hematopoietic stem cell transplantation for patients with AML in first complete remission. Blood. 2016; 127:62–70.
- Kantarjian H, Kadia T, et al. Acute myeloid leukemia: current progress and future directions. Blood Cancer J. 2021;11:41.
- Araki D, Wood BL, et al. Allogeneic hematopoietic cell transplantation for acute myeloid leukemia. J Clin Oncol. 2016;34: 329–36.
- Fenwarth L, Thomas X, et al. A personalized approach to guide allogeneic stem cell transplantation in younger adults with acute myeloid leukemia. Blood. 2021;137: 524–32.